Gore su aromatski spojevi definirani kao spojevi koji nalikuju benzenu. No koja specifična svojstva benzena mora imati spoj da bi se klasificirao kao aromatski? Osim spojeva koji sadrže benzenske prstenove, postoje mnoge druge tvari koje se nazivaju aromati, iako neke od njih izgledom malo podsjećaju na benzen.
Koja su svojstva karakteristična za sve aromatske spojeve?
S empirijskog gledišta, aromatski spojevi su spojevi čija molekulska formula odgovara visokom stupnju nezasićenosti i koji, unatoč tome, ne podliježu reakcijama adicije koje su obično karakteristične za nezasićene spojeve. Umjesto adicijskih reakcija, ovi aromatski spojevi često prolaze kroz reakcije elektrofilne supstitucije, poput benzena. Uz inertnost u adicijskim reakcijama očituje se i neobična stabilnost ovih spojeva - niske vrijednosti toplina hidrogenacije i izgaranja. Aromatični spojevi imaju cikličku strukturu - obično sadrže petero-, šestero- ili sedmeročlane prstenove - i kada se proučavaju fizikalnim metodama njihove molekule su plosnate (ili gotovo ravne). Protoni u ovim spojevima imaju približno iste vrijednosti kemijskog pomaka u NMR spektrima (odjeljak 13.18) kao protoni u benzenu i njegovim derivatima.
S teorijske točke gledišta, da bi spoj bio aromatičan, njegova molekula mora sadržavati ciklički sustav delokaliziranih elektrona iznad i ispod ravnine molekule; Štoviše, oblak -elektrona mora sadržavati -elektrone. Drugim riječima, za stupanj stabilnosti koji je karakterističan za aromatske spojeve, sama delokalizacija nije dovoljna. Molekula mora sadržavati strogo definiran broj elektrona - 2, ili 6, ili 10, itd. Ovaj zahtjev, poznat kao Hückelovo pravilo ili pravilo (nazvano po Erichu Hückelu, Institut za teorijsku fiziku, Stuttgart), temelji se na kvantna mehanika a povezan je sa zahtjevima za popunjavanjem raznih orbitala koje tvore -oblak. Valjanost Hückelovog pravila dobro je potvrđena činjenicama.
Pogledajmo neke podatke koji potvrđuju Hückelovo pravilo. Benzen ima šest -elektrona, aromatski sekstet; broj šest je Hückelov broj za Osim benzena i sličnih tvari (naftalen, antracen, fenantren, poglavlje 35), također ćemo susresti veliki broj heterociklički spojevi koji imaju različita aromatska svojstva; kao što će biti pokazano, sličnim
Aromatski heterodikli uključuju one spojeve u kojima se može pojaviti aromatski sekstet.
Kao druge primjere, razmotrite sljedećih šest spojeva, od kojih svaki ima samo jednu rezonantnu strukturu:

Svaka je molekula hibrid pet ili šest ekvivalentnih struktura koje sadrže naboj ili nespareni elektron na svakom od ugljikovih atoma. Međutim, od ovih šest spojeva samo dva imaju neobično visoku stabilnost: ciklopentadienil anion i cikloheptatrienil kation (tropilijev ion).
Ciklopentadien je neobično jaka kiselina za ugljikovodik, što ukazuje na povećanu stabilnost aniona koji nastaje kada se vodikov ion odvoji. (Ciklopentadien je puno jača kiselina od cikloheptatriena, iako je potonji anion stabiliziran rezonancijom sedam struktura.) Diciklopentadieniliron (ferocen) je stabilna molekula koja ima sendvič strukturu u kojoj je atom željeza uklješten između dva peteročlana prstena. Sve veze ugljik-ugljik duge su 1,4 A. Ferocenski prstenovi podliježu tipičnim reakcijama aromatske supstitucije - sulfonaciji i Friedel-Craftsovoj reakciji.

Među derivatima cikloheptatrienila, kation je taj koji ima neobična svojstva. Tropilij bromid se topi, vrlo je topiv u vodi, ali je netopljiv u nepolarnim otapalima i taloži se odmah nakon djelovanja. Ovo ponašanje je neuobičajeno za organski bromid i sugerira da čak iu krutom stanju imamo posla s ionskim spojem u kojem je kation. zapravo je stabilan karbonijev ion.
Razmotrimo elektronička konfiguracija ciklopentadienil anion (slika 10.5). Svaki atom ugljika je trigonalno hibridiziran i vezan -vezama s dva druga atoma ugljika i jednim atomom vodika. Prsten ciklopentadienil aniona je pravilan peterokut, čiji su kutovi ; određena nestabilnost koja proizlazi iz nesavršenog preklapanja (kutno naprezanje) više je nego kompenzirana rezultirajućom delokalizacijom. Četiri atoma ugljika imaju po jedan elektron u svakoj orbitali, a peti atom ugljika (onaj koji je izgubio proton, ali se u stvarnosti, naravno, ne razlikuje od ostalih) ima par elektrona.

Riža. 10.5. Ciklopentadienil anion. a - dva elektrona u a-orbitali jednog od atoma ugljika, po jedan elektron u -orbitali svakog od ostalih atoma ugljika; b - preklapanje -orbitala uz stvaranje -veza; c - oblaci iznad ili ispod ravnine prstena; postoji samo šest -elektrona, tj. aromatski sekstet.
Preklapanje -orbitala dovodi do stvaranja -oblaka koji sadrže ukupno šest elektrona, tj. aromatskog seksteta.
Konfiguracija tropilijskog iona prikazana je na sličan način. To je pravilan sedmerokut (kutovi jednaki 128,5° (2,242 rad)]. Svaki od šest ugljikovih atoma ima po jedan -elektron, a sedmi ima samo praznu -orbitalu. Rezultat je aromatski sekstet.
Razmatrani ioni najprikladnije su predstavljeni na sljedeći način:

Najčešći sustavi su oni s Hückelovim brojem šest, što je i razumljivo. Da bi atomi aromatskog prstena imali -orbitale, moraju biti u -hibridizaciji i, prema tome, idealno bi kutovi veze trebali biti jednaki kako bi bilo moguće preklapanje -orbitala, što dovodi do stvaranja -oblak, aromatski spoj mora biti ravan ili gotovo ravan. Broj trigonalno hibridiziranih atoma koji mogu formirati planarni prsten bez prevelikog kutnog naprezanja je pet, šest ili sedam, a samo planarni prsten dopušta dovoljno preklapanja za stvaranje -veze. Hückelov broj od šest odgovara broju -elektrona koji se mogu unijeti zajednički sustav navedeni broj atoma prstena. (Nije slučajno da je benzen, primjer aromatskog spoja, također idealna struktura: sadrži šest atoma sposobnih donirati šest elektrona i formirati šesterokut, čiji su kutovi točno trigonalni.)
Razmotrimo sada koji dokazi postoje da su drugi Hückelovi brojevi također “magični brojevi”? U tim slučajevima ne može se očekivati da će se aromatski karakter nužno očitovati u ekstremnoj stabilnosti spojeva usporedivoj s onom benzena i srodnih spojeva. Prstenovi s ovim brojem atoma ugljika bit će premali ili preveliki da dobro prihvate trigonalno hibridizirane atome ugljika. Stoga se svaka stabilizacija zbog aromatičnosti može u velikoj mjeri kompenzirati kutnim naprezanjem ili. nizak stupanj preklapanja -orbitala ili oba faktora.
Stabilnost treba razmatrati samo u komparativnom smislu, kao što je učinjeno gore za derivate ciklopentadienila i cikloheptatrienila, a dokaz aromatičnosti treba vidjeti u činjenici da je jedna ili druga molekula stabilnija od srodnih. Pravilo je u potpunosti eksperimentalno potvrđeno. Trenutačni cilj istraživanja je razjasniti složenije pitanje, naime: pri kojoj se maksimalnoj nepovoljnoj kombinaciji kutnog naprezanja i elektrostatskog odbijanja zbog prisutnosti više naboja još može uočiti aromatičnost?
(vidi sken)
Aromatski ugljikovodici- spojevi ugljika i vodika, čija molekula sadrži benzenski prsten. Najvažniji predstavnici aromatskih ugljikovodika su benzen i njegovi homolozi - produkti zamjene jednog ili više vodikovih atoma u molekuli benzena ugljikovodičnim ostacima.

Struktura molekule benzena
Prvi aromatski spoj, benzen, otkrio je 1825. M. Faraday. Njegova molekularna formula je utvrđena - C6H6. Usporedimo li njegov sastav sa sastavom zasićenog ugljikovodika koji sadrži isti broj ugljikovih atoma - heksana (C 6 H 14), tada vidimo da benzen sadrži osam atoma vodika manje. Kao što je poznato, pojava višestrukih veza i ciklusa dovodi do smanjenja broja vodikovih atoma u molekuli ugljikovodika. Godine 1865. F. Kekule predložio je njegovu strukturnu formulu kao cikloheksantrien-1,3,5.

Dakle, molekula koja odgovara formuli Kekulé sadrži dvostruke veze, stoga benzen mora biti nezasićen, tj. lako prolaziti reakcije adicije: hidrogeniranje, bromiranje, hidratacija itd.

Međutim, podaci iz brojnih pokusa pokazali su da benzen se podvrgava adicijskim reakcijama samo u teškim uvjetima(pri visokim temperaturama i osvjetljenju), otporan na oksidaciju. Za njega su najkarakterističnije reakcije supstitucije Stoga je benzen po karakteru bliži zasićenim ugljikovodicima.
U pokušaju da objasne ove razlike, mnogi su znanstvenici predložili razne opcije struktura benzena. Struktura molekule benzena konačno je potvrđena reakcijom njegovog nastanka iz acetilena. U stvarnosti, veze ugljik-ugljik u benzenu su ekvivalentne, a njihova svojstva nisu slična onima jednostrukih ili dvostrukih veza.
Trenutno se benzen označava Kekuleovom formulom ili šesterokutom u kojem je prikazan krug.

Pa što je posebno u strukturi benzena?
Na temelju podataka istraživanja i proračuna zaključeno je da je svih šest atoma ugljika u stanju sp 2 hibridizacije i leže u istoj ravnini. Nehibridizirane p-orbitale ugljikovih atoma koji čine dvostruke veze (Kekuleova formula) okomite su na ravninu prstena i međusobno su paralelne.
One se međusobno preklapaju, tvoreći jedan π-sustav. Stoga je sustav izmjeničnih dvostrukih veza prikazan u Kekuléovoj formuli ciklički sustav konjugiranih, preklapajućih π veza. Ovaj sustav sastoji se od dva toroidalna (nalik na krafnu) područja gustoće elektrona koja leže s obje strane benzenskog prstena. Stoga je logičnije benzen prikazati kao pravilan šesterokut s krugom u središtu (π-sustav) nego kao cikloheksantrien-1,3,5.
Američki znanstvenik L. Pauling predložio je da se benzen predstavi u obliku dviju graničnih struktura koje se razlikuju u raspodjeli gustoće elektrona i neprestano se pretvaraju jedna u drugu:

Mjerenja duljine veze potvrđuju ovu pretpostavku. Utvrđeno je da sve C-C veze u benzenu imaju istu duljinu (0,139 nm). Nešto su kraći od pojedinačnih C-C veze(0,154 nm) i duži od dvostrukih (0,132 nm).
Također postoje spojevi čije molekule sadrže nekoliko cikličkih struktura, na primjer:

Izomerija i nomenklatura aromatskih ugljikovodika
Za homolozi benzena karakteristična je izomerija položaja više supstituenata. Najjednostavniji homolog benzena je toluen(metilbenzen) - nema takvih izomera; sljedeći homolog predstavljen je kao četiri izomera:

Osnova naziva aromatskog ugljikovodika s malim supstituentima je riječ benzen. Atomi u aromatskom prstenu su numerirani, počevši od starijeg zamjenika do nižeg:

Ako su supstituenti isti, tada numeriranje se provodi najkraćim putem: na primjer, tvar:

naziva se 1,3-dimetilbenzen, a ne 1,5-dimetilbenzen.
Prema staroj nomenklaturi, pozicije 2 i 6 nazivaju se ortopozicije, 4 - parapozicije, 3 i 5 - metapozicije.


Fizikalna svojstva aromatskih ugljikovodika
Benzen i njegovi najjednostavniji homolozi u normalnim uvjetima - vrlo otrovne tekućine s karakterističnim neugodnim mirisom. Slabo se otapaju u vodi, ali dobro u organskim otapalima.
Kemijska svojstva aromatskih ugljikovodika

Supstitucijske reakcije. Aromatski ugljikovodici podliježu reakcijama supstitucije.
1. Bromiranje. Prilikom reakcije s bromom u prisutnosti katalizatora, željezovog (III) bromida, jedan od atoma vodika u benzenskom prstenu može se zamijeniti atomom broma:

2. Nitracija benzena i njegovih homologa. Kada aromatski ugljikovodik reagira s dušičnom kiselinom u prisutnosti sumporne kiseline (smjesa sumporne i dušične kiseline nazvana nitrirajuća smjesa), atom vodika zamijenjen je nitro skupinom - NO 2:

Redukcijom nitrobenzena dobivamo anilin- tvar koja se koristi za dobivanje anilinskih boja:

Ova reakcija je nazvana po ruskom kemičaru Zininu.
Reakcije adicije. Aromatični spojevi također mogu biti podvrgnuti reakcijama adicije na benzenski prsten. U tom slučaju nastaju cikloheksan i njegovi derivati.
1. Hidrogenizacija. Katalitičko hidrogeniranje benzena odvija se na višoj temperaturi od hidrogeniranja alkena:

2. Kloriranje. Reakcija se događa kada se osvijetli ultraljubičastim svjetlom i predstavlja slobodni radikal:

Kemijska svojstva aromatskih ugljikovodika - sažetak



Homolozi benzena
Sastav njihovih molekula odgovara formuli CnH2n-6. Najbliži homolozi benzena su:
Svi homolozi benzena nakon toluena imaju izomeri. Izomerija se može povezati i s brojem i strukturom supstituenta (1, 2) i s položajem supstituenta u benzenskom prstenu (2, 3, 4). Veze opća formula C 8 H 10 :

Prema staroj nomenklaturi koja se koristi za označavanje relativnog položaja dva identična ili različita supstituenta na benzenskom prstenu, koriste se prefiksi orto-(skraćeno o-) - supstituenti se nalaze na susjednim atomima ugljika, meta-(m-) - kroz jedan atom ugljika i par-(n-) - supstituenti jedan nasuprot drugome.
Prvi članovi homolognog niza benzena su tekućine specifičnog mirisa. Lakši su od vode. Dobra su otapala. Homolozi benzena podliježu reakcijama supstitucije:
bromiranje:

nitracija:

Toluen se zagrijavanjem oksidira permanganatom:

Referentni materijal za polaganje testa:
Mendeljejeva tablica
Tablica topljivosti
ARENES
Aromatski ugljikovodici (areni) – ciklički ugljikovodici, objedinjeni konceptom aromatičnosti, koji određuje opći znakovi u strukturi i kemijskim svojstvima.
Klasifikacija
Na temelju broja benzenskih prstenova u molekuli, areni se dijele na na:
mononuklearni
višejezgreni

Nomenklatura i izomerija
Strukturni predak ugljikovodika benzenskog niza je benzen C6H6 od kojih su izvedeni sustavni nazivi homologa.
Za monocikličke spojeve zadržani su sljedeći nesustavni (trivijalni) nazivi:

Položaj supstituenata označen je najmanjim brojevima (smjer numeriranja nije bitan),
|
|
|
a za di-supstituirane spojeve možete koristiti oznaku orto, meta, par.
|
|
|
|
Ako postoje tri supstituenta u prstenu, oni bi trebali dobiti najmanje brojeve, tj. red "1,2,4" ima prednost u odnosu na "1,3,4".


1,2-dimetil-4-etilbenzen (točan naziv) 3,4-dimetil-1-etilbenzen (netočan naziv)
Izomerija monosupstituiranih arena posljedica je strukture ugljikovog skeleta supstituenta; u di- i polisupstituiranim homolozima benzena dodaje se dodatna izomerija uzrokovana različitim rasporedom supstituenata u jezgri.
Izomerija aromatskih ugljikovodika sastava C 9 H 12:
|
|
|
|
|
Fizička svojstva
Vrelišta i tališta arena viša su od alkana, alkena, alkina, slabo su polarni, netopljivi u vodi i dobro topljivi u nepolarnim organskim otapalima. Arene su tekućine ili krutine koje imaju specifične mirise. Benzeni i mnogi kondenzirani areni su otrovni, neki od njih pokazuju kancerogena svojstva. Međuprodukti oksidacije kondenziranih arena u tijelu su epoksidi, koji ili sami izravno uzrokuju rak ili su prekursori karcinogena.
Dobivanje arena
Mnogi aromatski ugljikovodici imaju važne praktični značaj i proizvode se u velikim industrijskim razmjerima. Brojne industrijske metode temelje se na preradi ugljena i nafte.
Nafta se sastoji uglavnom od alifatskih i alicikličkih ugljikovodika; razvijene su metode za aromatiziranje ulja, čiju je kemijsku osnovu razvio N.D. Zelinsky, B.A. Kazansky.
1. Ciklizacija i dehidrogenacija:
2. Hidrodesmetilacija:

3. Homolozi benzena pripremaju se alkilacijom ili acilacijom nakon koje slijedi redukcija karbonilne skupine.
a) Friedel-Craftsova alkilacija:

b) Friedel-Craftsova acilacija:

4. Dobivanje bifenila Wurtz-Fittingovom reakcijom:
5. Dobivanje difenilmetana Friedel-Craftsovom reakcijom:
Struktura i Kemijska svojstva.
Kriteriji aromatičnosti:
Na temelju teoretskih izračuna i eksperimentalnih istraživanja cikličkih konjugiranih sustava, utvrđeno je da je spoj aromatičan ako ima:
- Ravni ciklički σ-kostur;
- Konjugirano zatvoreno π -elektronički sustav, koji pokriva sve atome ciklusa i sadrži 4n + 2, gdje je n = 0, 1, 2, 3, itd. Ova formulacija je poznata kao Hückelovo pravilo. Kriteriji aromatičnosti omogućuju razlikovanje konjugiranih aromatskih sustava od svih ostalih. Benzen sadrži sekstet π elektrona i slijedi Hückelovo pravilo pri n = 1.
Što daje aromatičnost:
Unatoč visokom stupnju nezasićenosti, aromatski spojevi su otporni na oksidirajuće agense i temperaturu, te su skloniji reakcijama supstitucije nego reakcijama dodavanja. Ovi spojevi imaju povećanu termodinamičku stabilnost, što je osigurano visokom energijom konjugacije sustava aromatskih prstenova (150 kJ/mol); stoga areni ponajprije ulaze u reakcije supstitucije, zbog čega zadržavaju aromatičnost.
Mehanizam reakcija elektrofilne supstitucije u aromatskom prstenu:
Gustoća elektrona π-konjugiranog sustava benzenskog prstena pogodna je meta za napad elektrofilnih reagensa.
Tipično, elektrofilni reagensi nastaju tijekom reakcije upotrebom katalizatora i odgovarajućih uvjeta.
E – Y → E δ + – Y δ - → E + + Y -
Stvaranje π-kompleksa. Inicijalni napad elektrofila π-elektronskog oblaka prstena dovodi do koordinacije reagensa s π-sustavom i stvaranja kompleksa tipa donor-akceptor tzv. π-kompleks. Sustav arome nije poremećen:

Stvaranje σ-kompleksa. Ograničavajuća faza, u kojoj elektrofil stvara kovalentnu vezu s atomom ugljika zbog dva elektrona π-sustava prstena, što je popraćeno prijelazom ovog atoma ugljika iz sp 2 - V sp 3 - hibridnog stanja i aromatskog poremećaja, molekula prelazi u karbokation.

Stabilizacija σ-kompleksa. Provodi se oduzimanjem protona iz σ-kompleksa pomoću baze. U tom slučaju, zbog dva elektrona kidanja kovalentne veze C–H, ponovno se uspostavlja zatvoreni π-sustav prstena, tj. molekula se vraća u aromatsko stanje:

Učinak supstituenata na reaktivnost i orijentaciju elektrofilne supstitucije
Supstituenti na benzenskom prstenu remete jednoličnost raspodjele π- elektronski oblak prstena i time utjecati na reaktivnost prstena.
- Supstituenti koji doniraju elektrone (D) povećavaju gustoću elektrona u prstenu i povećavaju brzinu elektrofilne supstitucije; aktiviranje.
- Supstituenti koji privlače elektrone (A) smanjuju gustoću elektrona prstena i reduciraju brzina reakcije, se zovu dekontaminirajući.
Ciklički konjugirani sustavi od velikog su interesa kao skupina spojeva s povećanom termodinamičkom stabilnošću u usporedbi s konjugiranim otvorenim sustavima. Ovi spojevi također imaju druga posebna svojstva, čija se ukupnost kombinira opći koncept aromatičnost. To uključuje sposobnost takvih formalno nezasićenih spojeva da se podvrgnu reakcijama supstitucije, a ne adicije, otpornost na oksidirajuća sredstva i temperaturu.
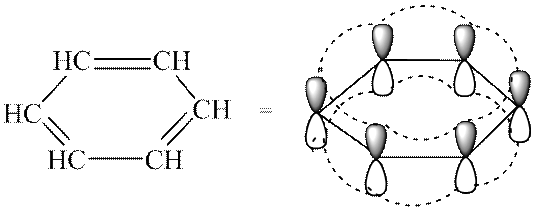
Tipični predstavnici aromatskih sustava su areni i njihovi derivati. Značajke elektroničke strukture aromatskih ugljikovodika jasno se očituju u modelu atomske orbite molekule benzena. Benzenov okvir formira šest sp 2 -hibridiziranih atoma ugljika. Sve σ veze (C-C i C-H) leže u istoj ravnini. Šest nehibridiziranih p-AO smješteno je okomito na ravninu molekule i međusobno paralelno (slika 3a). Svaki R-AO se mogu ravnopravno preklapati s dva susjedna R-AO. Kao rezultat takvog preklapanja nastaje jedan delokalizirani π-sustav, čija se najveća gustoća elektrona nalazi iznad i ispod ravnine σ-kostura i pokriva sve atome ugljika ciklusa (vidi sliku 3, b). Gustoća π-elektrona ravnomjerno je raspoređena kroz ciklički sustav, što je označeno kružićem ili isprekidanom linijom unutar ciklusa (vidi sliku 3, c). Sve veze između atoma ugljika u benzenskom prstenu imaju istu duljinu (0,139 nm), posrednu između duljina jednostruke i dvostruke veze.
Na temelju kvantno mehaničkih proračuna utvrđeno je da za nastanak takvih stabilnih molekula ravan ciklički sustav mora sadržavati (4n + 2) π elektrona, gdje je n= 1, 2, 3 itd. (Hückelovo pravilo, 1931). Uzimajući u obzir ove podatke, može se odrediti pojam "aromatičnosti".
Aroma sustavi (molekule)– sustavi koji ispunjavaju kriteriji aromatičnosti :
1) prisutnost ravnog σ-kostura koji se sastoji od sp 2 -hibridiziranih atoma;
2) delokalizacija elektrona, što dovodi do stvaranja jednog oblaka π-elektrona koji pokriva sve atome ciklusa (ciklusa);
3) usklađenost s pravilom E. Hückela, tj. elektronski oblak treba sadržavati 4n+2 π-elektrona, gdje je n=1,2,3,4... (obično broj označava broj ciklusa u molekuli);
4) visok stupanj termodinamička stabilnost (visoka energija konjugacije).
Riža. 3. Model atomske orbite molekule benzena (atomi vodika izostavljeni; objašnjenje u tekstu)
Stabilnost spojenih sustava. Stvaranje konjugiranog, a posebno aromatskog sustava je energetski povoljan proces, jer se time povećava stupanj preklapanja orbitala i dolazi do delokalizacije (raspršivanja). R-elektroni. U tom smislu, konjugirani i aromatski sustavi imaju povećanu termodinamičku stabilnost. Sadrže manju zalihu unutarnje energije i u osnovnom stanju zauzimaju manju razina energije u usporedbi s nespregnutim sustavima. Iz razlike između ovih razina može se kvantificirati termodinamička stabilnost konjugiranog spoja, tj. energija konjugacije (energija delokalizacije). Za butadien-1,3 je mala i iznosi oko 15 kJ/mol. Povećanjem duljine konjugiranog lanca povećava se energija konjugacije, a time i termodinamička stabilnost spojeva. Energija konjugacije za benzen je znatno veća i iznosi 150 kJ/mol.
Primjeri nebenzenoidnih aromatskih spojeva:
Piridin Po elektronička struktura nalikuje benzenu. Svi atomi ugljika i atom dušika su u stanju sp 2 hibridizacije, a sve σ veze (C-C, C-N i C-H) leže u istoj ravnini (slika 4, a). Od tri hibridne orbitale atoma dušika, dvije sudjeluju u nastanku
Riža. 4. Piridin dušikov atom (A), (b) i konjugirani sustav u molekuli piridina (c) ( S-N veze izostavljeno radi pojednostavljenja slike)
σ veze s atomima ugljika (prikazane su samo osi ovih orbitala), a treća orbitala sadrži usamljeni par elektrona i ne sudjeluje u stvaranju veze. Atom dušika s ovom elektronskom konfiguracijom naziva se piridin.
Zbog elektrona koji se nalazi u nehibridiziranoj p-orbitali (vidi sliku 4, b), atom dušika sudjeluje u formiranju jednog elektronskog oblaka s R-elektroni pet ugljikovih atoma (vidi sliku 4, c). Dakle, piridin je π,π-konjugirani sustav i zadovoljava kriterije aromatičnosti.
Kao rezultat veće elektronegativnosti u usporedbi s atomom ugljika, atom piridinskog dušika snižava gustoću elektrona na atomima ugljika aromatskog prstena, stoga se sustavi s atomom piridinskog dušika nazivaju π-nedovoljan. Uz piridin, primjer takvih sustava je pirimidin, koji sadrži dva piridinska dušikova atoma.
pirol također se odnosi na aromatske spojeve. Atomi ugljika i dušika u njemu su, kao i u piridinu, u stanju sp2 hibridizacije. Međutim, za razliku od piridina, atom dušika u pirolu ima drugačiju elektronsku konfiguraciju (slika 5, a, b).
Riža. 5. Pirol dušikov atom (A), raspodjela elektrona među orbitalama (b) i konjugirani sustav u molekuli pirola (c) (C-H veze su izostavljene radi pojednostavljenja slike)
Na nehibridiziranom R-orbitala atoma dušika sadrži usamljeni par elektrona. Uključena je u sparivanje sa R-elektroni četiri atoma ugljika da tvore jedan oblak od šest elektrona (vidi sliku 5, c). Tri sp 2 hibridne orbitale tvore tri σ veze - dvije s atomima ugljika, jedna s atomom vodika. Atom dušika u tom elektronskom stanju naziva se pirol.
Oblak od šest elektrona u pirolu zahvaljujući p,str-konjugacija je delokalizirana na pet atoma prstena pa je pirol π-višak sustav.
U furan I tiofen aromatski sekstet također uključuje usamljeni par elektrona iz nehibridiziranog p-AO kisika, odnosno sumpora. U imidazol I pirazol Dva atoma dušika daju različite doprinose stvaranju delokaliziranog elektronskog oblaka: atom dušika pirola daje par π elektrona, a atom dušika piridina daje jedan p elektron.
Također ima aromatična svojstva purin, predstavlja kondenzirani sustav dva heterocikla – pirimidina i imidazola.
Delalizirani elektronski oblak u purinu uključuje 8 elektrona dvostruke veze π i usamljeni par elektrona iz atoma N=9. Ukupan broj elektrona u konjugaciji, jednak deset, odgovara Hückelovoj formuli (4n + 2, gdje n = 2).
Heterociklički aromatski spojevi imaju visoku termodinamičku stabilnost. Nije iznenađujuće da oni služe kao strukturne jedinice najvažnijih biopolimera - nukleinskih kiselina.
U organskoj kemiji, takav koncept kao aromatičnost neki organski spojevi. Pojam "aromatičnost" prvenstveno se povezuje s benzenom, njegovim homolozima i brojnim derivatima. Ovaj pojam odnosi se isključivo na strukturu molekula tih tvari, njihova svojstva, ali nema nikakve veze s njihovim mirisom. Istina, prvi aromatični spojevi vjerojatno su imali ugodan miris (neki prirodni eteri, mirisne smole, npr. tamjan i sl.).
Aromatičnost - zajednička značajka nekih cikličkih organskih spojeva koji imaju skup posebnih svojstava.
Prisutnost jednog zatvorenog sustava π-elektrona u molekuli - glavni znak aromatičnosti.
Aromatični spojevi poštuju pravilo E. Hückel (1931):
Planarni monociklički spojevi koji imaju konjugirani sustav π-elektrona mogu biti aromatični ako je broj tih elektrona 4n+2 (gdje je n = 0,1,2,3, 4 itd., tj. broj π-elektrona u molekuli može biti 2, 6, 10, 14, 18 itd.).
Ove značajke određuju sva najvažnija fizikalna i kemijska svojstva aromatskih spojeva. Na primjer, podvrgnuti su pretežno reakcijama supstitucije (uglavnom elektrofilnim), a ne reakcijama dodavanja (unatoč formalnoj nezasićenosti). Aromatični spojevi su vrlo otporni, na primjer, na oksidirajuća sredstva. Njihove molekule imaju ravnu strukturu. Ako ovaj zahtjev nije ispunjen, paralelizam osi 2p orbitala u molekuli je poremećen, što dovodi do eliminacije konjugacije i, kao posljedica toga, do kršenja jednolikosti gustoće π-elektrona u molekuli. sustav.
Nomenklatura
Sustavni naziv svih aromatskih ugljikovodika je arene i benzen - benzen . Homolozi benzena smatraju se supstituiranim benzenima, a brojevi označavaju položaj supstituenata. Međutim, sustavna nomenklatura dopušta naziv "benzen", a za neke homologe benzena - trivijalne nazive: vinilbenzen (I) se naziva stiren, metilbenzen (II) - toluen, dimetilbenzen (III) - ksilol, izopropilbenzen (IV) - kumen, metoksibenzen (V) - anisol itd.:
Aromatski radikali imaju uobičajeno ime - Arils(Ar). Radikal C 6 H 5 - tzv fenil(od starog naziva za benzen - "fen za kosu").
Izomerija.
Opća formula homologa benzena je C n H 2 n -6. Svih šest atoma vodika u molekuli benzena je identično, a kada se jedan od njih zamijeni istim radikalom, nastaje isti spoj. Stoga monosupstituirani benzen nema izomere. Na primjer, postoji samo jedan metilbenzen:

Kada se dva atoma vodika zamijene metilnim skupinama, nastaju tri izomera - ksileni, koji se međusobno razlikuju po rasporedu supstituenata u prstenu:



orto-dimetilbenzen, meta-dimetilbenzen, par-dimetilbenzen,
ili 1,2-dimetilbenzen ili 1,3-dimetilbenzen ili 1,4-dimetilbenzen
(O-ksilen) ( m-ksilen) ( P-ksilen)
Umjesto slovne oznake ( orto-, meta-, para-, ili skraćeno: o-, m-, p-) možete koristiti digitalno: 1,2-, 1,3-, 1,4-. Izomeri se mogu razlikovati po prirodi svojih supstituenata:


propilbenzen izopropilbenzen