Benzen je bezbojna, vrlo pokretljiva tekućina karakterističnog mirisa. Da vidimo otapa li se benzen u vodi, alkoholu i eteru. U tri epruvete ulijte malo benzena i u prvu epruvetu dodajte vodu, u drugu alkohol, a u treću eter. Benzen je vrlo topiv u alkoholu i eteru. Benzen je slabo topljiv u vodi i pluta na vrhu kao lakša tekućina. Samo 0,08 g benzena se otapa u 100 ml vode. Benzen je dobro otapalo. Pomiješajte malo benzena s ricinusovim uljem. Miješanjem se ulje otapa u benzenu. Pogledajmo kako se benzen smrzava. U čašu s mješavinom leda i vode spustimo dvije epruvete: jednu napunjenu destiliranom vodom, drugu benzenom. Nakon nekog vremena benzen počinje kristalizirati. Benzen se smrzava i pretvara u bijelu kristalnu masu. Ledište benzena +5,5 ° C. Voda u susjednoj epruveti ostaje tekuća. Kad se epruveta izvadi iz rashladne smjese, benzen se otopi i ponovno postane tekući.
Oprema: epruvete, kristalizator, stalak za epruvete.
Sigurnosne mjere opreza. Pazite da vam benzen ne dospije na kožu.
Izgaranje benzena
Benzen sadrži oko 92% ugljika, a nepotpunim izgaranjem benzena nastaje mnogo čađe. Donesimo goruću krhotinu u šalicu benzena. Benzen bljesne brzo i gori jakim, vrlo zadimljenim plamenom. Pri sagorijevanju benzena nastaju ugljikov dioksid i vodena para.
2C 6 H 6 + 15 O 2 = 12 CO 2 + 6 H 2 O
Oprema: vatrostalna brtva, krhotina, porculanska šalica.
Sigurnosne mjere opreza.
Proučavanje omjera benzena i bromne vode
i otopina kalijevog permanganata
Dodajmo malo bromne vode benzenu. Protresite smjesu. Iz bromne vode brom prelazi u gornji sloj benzena i boji ga. Topljivost broma u benzenu veća je od topivosti broma u vodi. U tim uvjetima brom ne reagira s benzenom. U drugu epruvetu s benzolom ulijte otopinu kalijeva permanganata. Ovdje također ne primjećujemo pojavu kemijske reakcije. Benzen ne daje reakcije karakteristične za nezasićene ugljikovodike. Benzen ne dodaje brom i ne oksidira se otopinom kalijevog permanganata.
Oprema:
Sigurnosne mjere opreza. Pazite da vam benzen ne dospije na kožu. Pridržavajte se pravila za rad sa zapaljivim tekućinama.
Bromiranje benzena
U tikvicu ulijemo 4 ml benzena i dodamo malo broma. Zatvorite tikvicu čepom s cijevi za odvod plina. Za upijanje bromovih para između čepa i cijevi za odvod plina stavimo cijev kalcijevog klorida s aktivnim ugljenom. Stavite kraj cijevi za odvod plina u čašu vode. Benzen otapa brom, ali reakcija ne teče. Dodajte malo metalnog željeza u smjesu. Počinje reakcija. Željezo i brom tvore željezov(III) bromid, koji katalizira reakciju. Produkti reakcije su bromobenzen i bromovodik.
C6H6 + Br2 = C6H5Br + HBr
Nakon što je reakcija završena, izlijte smjesu iz tikvice u vodu. Bromobenzen tone na dno čaše, jer je, za razliku od benzena, bromobenzen teška tekućina. Dokažimo da je kao rezultat reakcije osim brombenzena nastao i bromovodik. Da biste to učinili, dodajte plavi lakmus u vodenu otopinu bromovodika. Mijenja boju - postaje ružičasta. To znači da je u otopini nastala kiselina. U drugi dio otopine dodajte malo otopine srebrnog nitrata - nastaje žućkasti talog srebrnog bromida.
HBr + AgNO 3 = AgBr ↓ + HNO 3
U prisutnosti katalizatora željeznog bromida, benzen reagira s bromom da bi se formirao bromobenzen i bromovodik. Tip reakcije je reakcija zamjene.
Natrijev karbonat u vodenoj otopini reagira s bromom, stvarajući bezbojne produkte reakcije: kao rezultat, smeđa boja broma nestaje.
2Na 2 CO 3 + H 2 O + Br 2 = 2NaHCO 3 + NaBr + NaBrO
Oprema: tikvica s okruglim dnom, epruvete, cijev za odvod plina, lijevak, tronožac.
Sigurnosne mjere opreza. Pazite da vam benzen ne dospije na kožu. Pridržavajte se pravila za rad sa zapaljivim tekućinama. Pokus se izvodi pod trakcijom.
Kloriranje benzena (proizvodnja heksaklorana)
Pod utjecajem svjetla benzen može dodati klor. U tikvicu napunjenu plinovitim klorom ulijte malo benzena i brzo je zatvorite čepom. U normalnim uvjetima ne dolazi do reakcije između klora i benzena. Osvijetlimo tikvicu električnom lampom - pojavljuje se bijeli dim, to su sitni kristali heksaklorocikloheksana. Boja klora nestaje kako benzen dodaje klor. Produkt reakcije je heksaklorocikloheksan ili heksakloran.
C6H6 + 3CI2 = C6H6CI6
Heksakloran je jedan od najjačih insekticida - kemijskih sredstava za suzbijanje štetnih insekata.
Oprema: tikvica volumena 500-1000 ml, čep, tronožac, jak izvor svjetla.
Sigurnosne mjere opreza. Pazite da vam benzen ne dospije na kožu. Pridržavajte se pravila za rad sa zapaljivim tekućinama. Pokus se izvodi pod trakcijom. Nakon pokusa tikvicu isprati alkoholom, a zatim otopinom lužine. Tretirajte otopinu alkohola sa smjesom kroma. Sve radnje treba izvoditi samo pod vučom.
Fizikalna svojstva alkohola
Monohidrični alkoholi, koji sadrže do deset ugljikovih atoma, u normalnim su uvjetima tekućine. Alkoholi koji sadrže 11 atoma ugljika ili više su krutine. Etilni, butilni i izoamilni alkohol su tekućine.
Pogledajmo kako se alkoholi otapaju u vodi. U tri epruvete ulijte nekoliko mililitara alkohola i dodajte im obojenu vodu. Alkoholi imaju gustoću manju od jedan, pa čine gornji sloj. Kada se epruvete protresu, etilni alkohol se potpuno otapa, butilni alkohol se djelomično otapa, a izoamilni alkohol se gotovo ne otapa. Boja prelazi iz vodene otopine u alkohole. S povećanjem molekulske mase i povećanjem ugljikovodičnih radikala, topljivost alkohola u vodi opada.
Oprema: epruvete, stalak za epruvete, čaše.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama.
Goreći alkoholi
U porculanske šalice ulijte malo etilnog, butilnog i izoamilnog alkohola. Prinesimo goruću baklju čašama. Etilni alkohol se brzo zapali i gori plavičastim, slabo blistavim plamenom. Butil alkohol gori blistavim plamenom. Izoamil alkohol se teže zapali i gori zadimljenim plamenom. S povećanjem molekulske mase monohidričnih alkohola povećava se vrelište i povećava se svjetlina njihova plamena.
C2H5OH + 3O2 = 2CO2 + 3 H2O
C4H9OH + 6O2 = 4CO2 + 5 H2O
2C 5 H 11 OH + 15 O 2 = 10 CO 2 + 12 H 2 O
Oprema: vatrostalna brtva, porculanske šalice, svjetiljka.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama.
Reakcija etilnog alkohola s metalnim natrijem
Kada alkoholi reagiraju s natrijem, nastaju plin vodik i odgovarajući natrijevi alkoholati. Pripremimo epruvete s metilnim, etilnim i butilnim alkoholom. Stavite komadić metalnog natrija u epruvetu s metilnim alkoholom. Počinje žustra reakcija. Natrij se topi i oslobađa se vodik.
2CH3OH + 2Na = 2CH3ONa + H2
Stavimo natrij u epruvetu s etilnim alkoholom. Reakcija je malo sporija. Oslobođeni vodik može se zapaliti. Na kraju reakcije izoliramo natrijev etoksid. Da biste to učinili, spustite staklenu šipku u epruvetu i držite je iznad plamena plamenika. Višak alkohola ispari. Bijeli sloj natrijevog etoksida ostaje na štapiću.
2C 2 H 5 OH + 2 Na = 2 C 2 H 5 ONa + H 2
U epruveti s butilnim alkoholom reakcija s natrijem još je sporija.
2C 4 H 9 OH + 2 Na = 2 C 4 H 9 ONa + H 2
Dakle, s produljenjem i grananjem ugljikovodičnog radikala, brzina reakcije alkohola s natrijem se smanjuje.
Oprema: stalak za epruvete, epruvete, pinceta, skalpel, filter papir.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama i alkalnim metalima.
Reakcija etilnog alkohola s bromovodikom
Alkoholi reagiraju s halogenovodikom. U uređaj za dobivanje haloalkana ulijte smjesu etilnog alkohola i koncentrirane sumporne kiseline. U smjesu prvo dodajte nekoliko kapi vode, a zatim natrijev bromid. Ulijte vodu u gornji dio aparata, hladnjaka i dodajte komadiće leda. Zagrijmo tikvicu. Nakon nekog vremena počinje reakcija. Natrijev bromid reagira sa sumpornom kiselinom i nastaje bromovodik.
NaBr + H2SO4 = NaHSO4 + HBr
Bromovodik reagira s etilnim alkoholom i nastaje bromoetan.
HBr + C2H5OH = C2H5Br + H2O
Bromoetan je tekućina niskog vrelišta. Bromoetan isparava, para ulazi u hladnjak, gdje se bromoetan kondenzira. Kapljice bromoetana padaju u prijemnik. Teška uljasta tekućina, bromoetan, skuplja se na dnu spremnika.
Oprema: uređaj za dobivanje haloalkana, stalak, lopatica, plamenik, menzura, mjerna cijev
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama i kiselinama.
Proučavanje fizikalnih svojstava glicerina
Glicerin je prozirna, bezbojna, viskozna, slatkasto sirupasta tekućina. Glicerin je vrlo topljiv u vodi i miješa se s njom na bilo koji način. Otopine glicerina smrzavaju se na vrlo niskim temperaturama. Pripremite rashladnu smjesu kuhinjske soli i komadića leda. Stavimo dvije epruvete u nju. Jedna od epruveta sadrži vodu, a druga otopinu glicerola. Nakon nekog vremena voda se smrzava. Otopina glicerina ostaje tekuća. Glicerin i etilen glikol koriste se kao antifriz u hladnjaku automobila.
Oprema: epruvete, stalak, kristalizator.
Sigurnosne mjere opreza. Iskustvo je sigurno.
Interakcija glicerola s metalnim natrijem
Poput monohidričnih alkohola, polihidrični alkoholi reagiraju s metalnim natrijem. Ubacite komadić natrija u epruvetu s glicerinom. Lagano zagrijte epruvetu. Reakcija se isprva odvija polako, a zatim sve snažnije. Oslobođeni vodik može se zapaliti. Reakcija se odvija vrlo snažno, oslobađa se mnogo topline, au završnoj fazi reakcije dolazi do pougljenjivanja glicerina.
Oprema:čaša, epruveta, stakleni štapić, skalpel, pinceta, filter papir.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s alkalnim metalima.
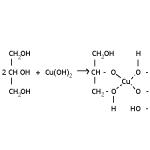
Reakcija polihidričnih alkohola s bakrovim (II) hidroksidom
S povećanjem broja hidroksilnih skupina u molekuli tvari povećava se pokretljivost vodikovih atoma, tj. svojstva kiseline se povećavaju. Stoga se atomi vodika u polihidričnim alkoholima mogu zamijeniti ne samo alkalijskim metalima, već i manje aktivnim metalima. Bakrov (II) hidroksid dobivamo spajanjem otopina natrijevog hidroksida i bakrovog (II) sulfata. Dobiveni talog dodajte glicerinu. Talog bakrenog hidroksida se otapa i nastaje tamnoplava otopina bakrovog (II) glicerata. Dodajte talog bakrenog hidroksida u otopinu etilenglikola. Također se stvara tamnoplava otopina. Reakcija s bakrovim(II) hidroksidom je kvalitativna reakcija na polihidrične alkohole.

Oprema: epruvete, stakleni štap.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s alkalijama i njihovim otopinama.
Interakcija glicerola s kristalnim kalijevim permanganatom
Kalijevom permanganatu samljevenom u fini prah dodajte malo glicerina. Nakon nekog vremena iznad smjese se pojavi dim, a zatim se glicerin zapali. Pod utjecajem jakih oksidansa glicerin izgara pri čemu nastaje ugljikov dioksid i voda.
2 C 3 H 8 O 3 + 7 O 2 = 6 CO 2 + 8 H 2 O
Oprema: vatrostalna brtva, filter papir, lopatica.
Sigurnosne mjere opreza. Pridržavajte se pravila zaštite od požara. Ne dopustite da kalijev permanganat dođe u dodir s odjećom ili kožom.
Proučavanje fizikalnih svojstava fenola
Čisti fenol su bezbojni kristali karakterističnog mirisa. Tijekom skladištenja fenol djelomično oksidira i dobiva ružičastu ili crvenu boju. Provjerimo topljivost fenola u vodi. Da biste to učinili, dodajte malo vode u nekoliko kristala fenola. Fenol je slabo topljiv u vodi. Mućkanjem nastaje suspenzija fenola u vodi.
Oprema: epruvete, stalak za epruvete, plamenik, lopatica.
Sigurnosne mjere opreza.
Reakcija fenola s metalnim natrijem
Kao i alkoholi, fenol reagira s alkalijskim metalima. Stavimo malo fenola u epruvetu. Zagrijte fenol dok se ne otopi. Kada metalni natrij dođe u kontakt s rastaljenim fenolom, dolazi do snažne reakcije. Kao rezultat reakcije nastaje natrijev fenolat i oslobađa se vodik. Ova reakcija dokazuje sličnost fenola s monohidričnim alkoholima.
2C 6 H 5 OH + 2Na = 2C 6 H 5 ONa + H 2
Oprema: epruveta, skalpel, pinceta, filter papir, plamenik.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s otrovnim tvarima. Fenol uzrokuje opekline kože. Izbjegavajte kontakt fenola s kožom. Pridržavajte se pravila za rad s alkalnim metalima.
Interakcija fenola s otopinom lužine
Fenol pokazuje veća kisela svojstva u usporedbi s monohidričnim alkoholima. Sposoban je reagirati s otopinama alkalija. U vodenu emulziju fenola dodajte nekoliko kapi otopine natrijevog hidroksida. Nastaje bistra otopina natrijeva fenolata.
C6H5OH + NaOH = C6H5ONa + H2O
Oprema:
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s otrovnim tvarima. Fenol uzrokuje opekline kože. Izbjegavajte kontakt fenola s kožom. Pridržavajte se pravila za rad s alkalijama i njihovim otopinama.
Reakcija fenola s bromnom vodom
Otopini fenola u vodi dodajte malo bromne vode. U otopini se pojavljuje bijela suspenzija - taloži se talog tribromfenola. Kao rezultat međusobnog utjecaja atoma u molekuli fenola, ne jedan, već tri atoma vodika zamijenjena su bromom. Ova reakcija je jedna od kvalitativnih reakcija na fenol.

Oprema: epruvete, stalak za epruvete, lopatica.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s otrovnim tvarima. Fenol uzrokuje opekline kože. Izbjegavajte kontakt fenola s kožom.
Kvalitativna reakcija na etanol
Osjetljiva reakcija na etilni alkohol je takozvani jodoformni test: stvaranje karakterističnog žućkastog taloga jodoforma kada je alkohol izložen jodu i lužini. Ovom reakcijom može se utvrditi prisutnost alkohola u vodi čak i pri koncentraciji od 0,05%. Uzmimo uzorak otopine i dodamo Lugolovu otopinu. Lugolova otopina sadrži jod (1 dio joda, 2 dijela kalijevog jodida, 17 dijelova sterilne destilirane vode). Kada se otopina ohladi, pojavljuje se žuta suspenzija jodoforma, taloži se žuti talog jodoforma.
C 2 H 5 OH + 6 NaOH + 4 I 2 = CHI 3 + HCOONa + 5 NaI + H 2 O
Oprema: epruvete, stezaljka za epruvete, plamenik.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s uređajima za grijanje.
Kvalitativna reakcija na fenol
Kvalitativna reakcija na fenol je reakcija sa željeznim (III) kloridom. Dodajte otopinu željezovog klorida visoko razrijeđenoj otopini fenola. Tekućina u epruveti postaje tamnoljubičasta. Koristeći ovu reakciju, fenol se može odrediti čak iu vrlo niskim koncentracijama.
Oprema: epruvete, stalak za epruvete.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s otrovnim tvarima. Izbjegavajte kontakt fenola s kožom.
Oksidacija etilnog alkohola bakrovim(II) oksidom
U uređaj za oksidaciju alkohola ulijte malo etilnog alkohola. Spojimo uređaj za dovod zraka na izlaznu cijev za plin. Zagrijte bakrenu spiralu u plameniku i stavite je u uređaj. Pustimo struju zraka u uređaj. Bakrena spirala u uređaju nastavlja biti užarena kako počinje oksidacija alkohola. Produkt oksidacije alkohola je acetaldehid.
CH3-CH2-OH + CuO = CH3-COH + Cu + H2O
Aldehid detektiramo propuštanjem plinova koji izlaze iz uređaja kroz sumpornu kiselinu. Pod utjecajem aldehida fuksinozna kiselina dobiva ljubičastu boju. Pokažimo da je bakrena spirala užarena. Skinimo spiralu sa sprave i prinesimo joj šibicu. Šibica zasvijetli. Vidjeli smo da oksidacijom monohidričnih alkohola nastaju aldehidi.
Oprema: uređaj za oksidaciju alkohola, gumene cijevi, plamenik, plinometar ili aspirator.
Sigurnosne mjere opreza.
Oksidacija etilnog alkohola otopinom kalijeva permanganata
Alkoholi se lako oksidiraju otopinom kalijeva permanganata. U epruvetu s etilnim alkoholom ulijemo malo zakiseljenu otopinu kalijeva permanganata. Pažljivo zagrijte epruvetu. Otopina postupno postaje bezbojna. U tim uvjetima etilni alkohol se oksidira, pretvarajući se u acetaldehid.
Oprema: epruvete, stalak za epruvete.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama i uređajima za grijanje.
Oksidacija etilnog alkohola kristalnim kalijevim permanganatom
Reakcija etilnog alkohola s kalijevim permanganatom u prisutnosti koncentrirane sumporne kiseline odvija se vrlo snažno. Sumpornu kiselinu ulijte u stakleni cilindar. Pažljivo ulijte etilni alkohol duž zida. Formiraju se dva sloja tekućine. Vrh - etilni alkohol, dno - sumporna kiselina. Bacimo malo kristalnog kalijevog permanganata u cilindar. Nakon nekog vremena, na granici između alkohola i kiseline pojavljuju se bljeskovi i čuju se klikovi. Kada kristali kalijevog permanganata uđu u sumpornu kiselinu, nastaje manganov anhidrid (manganov (VII) oksid), vrlo jako oksidacijsko sredstvo. Interakcija je s etilnim alkoholom. Ovo proizvodi acetaldehid.
CH3-CH2-OH + [O] = CH3-COH + H2O
Oprema: cilindar, lopatica.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama i koncentriranim kiselinama. Nakon demonstracije pažljivo razrijediti sadržaj vodom i neutralizirati lužinom.
Katalitička oksidacija etanola
Oksidacija etilnog alkohola atmosferskim kisikom odvija se vrlo lako u prisutnosti krom (III) oksida. U porculansku šalicu stavite komadić vate namočen u alkohol. Zapalimo vatu. Pažljivo ulijte krom oksid na zapaljenu vatu. Plamen se gasi. Ali kromov oksid počinje se zagrijavati. Reakcija oksidacije alkohola odvija se uz oslobađanje energije. Produkt reakcije oksidacije alkohola je acetaldehid.
2CH 3 -CH 2 -OH + O 2 = 2CH 3 -COH + 2H 2 O
Oprema: porculanska šalica, lopatica.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama i koncentriranim kiselinama. Nakon demonstracije pažljivo razrijedite sadržaj čaše vodom i neutralizirajte lužinom.
Oksidacija etanola (alkotest)
Za utvrđivanje činjenice intoksikacije alkoholom koristi se reakcija oksidacije alkohola s jakim oksidansima.
Pripremimo epruvetu za određivanje alkohola. Da biste to učinili, usitnite kromni anhidrid (kromov (VI) oksid) s malom količinom sumporne kiseline u tarioniku. Rezultat je crvena pasta. Nanesite traku paste na stijenke cijevi. Spojimo cijev na uređaj koji dovodi mješavinu zraka i para etilnog alkohola. Nakon nekog vremena crvena pruga u cijevi postaje zelena. Alkohol se oksidira u acetaldehid, a oksidacijsko sredstvo kromov oksid prelazi u kromov (III) sulfat koji ima zelenu boju.
K 2 Cr 2 O 7 + 3 C 2 H 5 OH + 4 H 2 SO 4 = 3 CH 3 COH + Cr 2 (SO 4) 3 + K 2 SO 4 + 7 H 2 O
Oprema: porculanska čaša i tarionik, staklena cijev, gumene cijevi, plinometar ili aspirator
Sigurnosne mjere opreza. Pridržavajte se pravila za rad sa zapaljivim tekućinama.
Kvalitativna reakcija na aldehide s fuksinoznom kiselinom
Jedna od kvalitativnih reakcija koja omogućuje određivanje prisutnosti aldehida je reakcija s fuksinoznom kiselinom. Bezbojnu otopinu fuksinozne kiseline ulijte u epruvetu s otopinom formaldehida. Postupno se pojavljuje ljubičasta boja.
Oprema: epruvete, stalak za epruvete.
Sigurnosne mjere opreza.
Kvalitativna reakcija na aldehide s bakrovim (II) hidroksidom
Jedna od kvalitativnih reakcija na aldehide je reakcija s bakrovim (II) hidroksidom. Bakrov (II) hidroksid dobivamo spajanjem otopina natrijevog hidroksida i bakrovog (II) sulfata. Nastalom talogu dodajte otopinu formaldehida. Zagrijmo smjesu. Metalni bakar se oslobađa na stijenkama epruvete.
H-SON + Cu(OH) 2 = HCOOH + Cu + H 2 O
Međutim, ova reakcija češće rezultira stvaranjem crvenog taloga bakrovog (I) oksida.
H-SON + 2 Cu(OH) 2 = HCOOH + Cu 2 O↓+ 2 H 2 O
Oprema: epruvete, stalak za epruvete, stezaljka za epruvete, plamenik.
Sigurnosne mjere opreza. Pridržavajte se pravila za rad s otrovnim tvarima.
Topivost u vodi raznih karboksilnih kiselina
Octena i maslačna kiselina su tekućine na normalnim temperaturama, stearinska kiselina je krutina. Pogledajmo kako se ove karboksilne kiseline otapaju u vodi. U tri epruvete s vodom dodajte različite karboksilne kiseline. Octena i maslačna kiselina vrlo su topljive u vodi, ali stearinska kiselina je netopljiva u vodi. Ljubičasta otopina lakmusa mijenja boju samo u otopinama octene i maslačne kiseline. U epruveti koja sadrži stearinsku kiselinu lakmus ostaje ljubičast.
Benzen. Formula (1)
Benzen- organski spoj C 6 H 6, najjednostavniji aromatski ugljikovodik; pokretna bezbojna hlapljiva tekućina osebujnog blagog mirisa.
- tnl = 5,5°C;
- t kip = 80,1°C;
- gustoća 879,1 kg/m 3 (0,8791 g/cm 3) na 20°C.
Sa zrakom u volumnoj koncentraciji od 1,5-8%, benzen stvara eksplozivne smjese. Benzen se miješa u svim omjerima s eterom, benzinom i drugim organskim otapalima; 0,054 g vode otapa se u 100 g benzena pri 26°C; s vodom tvori azeotropnu (konstantno kipuću) smjesu (91,2 % benzena po težini) s t kip = 69,25°C.
Priča
Benzen je otkrio M. Faraday. (1825), koji ga je izolirao iz tekućeg kondenzata svjetlećeg plina; Benzen je 1833. godine u čistom obliku dobio E. Mitscherlich suhom destilacijom kalcijeve soli benzojeve kiseline (otuda naziv).
Godine 1865. F.A. Kekule predložio je strukturnu formulu za benzen koja odgovara cikloheksatrienu - zatvorenom lancu od 6 atoma ugljika s izmjeničnim jednostrukim i dvostrukim vezama. Kekule formula se koristi prilično široko, iako su se nakupile mnoge činjenice koje pokazuju da benzen nema strukturu cikloheksatriena. Tako je odavno utvrđeno da orto-disupstituirani benzeni postoje samo u jednom obliku, dok Kekuleova formula dopušta izomeriju takvih spojeva (supstituenti na ugljikovim atomima povezani jednostrukom ili dvostrukom vezom). Godine 1872. Kekule je dodatno uveo hipotezu da se veze u benzenu stalno i vrlo brzo kreću i osciliraju. Predložene su i druge formule za strukturu benzena, ali nisu dobile priznanje.
Kemijska svojstva

Benzen. Formula (2)
Kemijska svojstva benzena formalno donekle odgovaraju formuli (1). Dakle, pod određenim uvjetima, 3 molekule klora ili 3 molekule vodika se dodaju molekuli benzena; benzen nastaje kondenzacijom 3 molekule acetilena. Međutim, benzen uglavnom nije karakteriziran reakcijama adicije tipičnim za nezasićene spojeve, već reakcijama elektrofilne supstitucije. Osim toga, benzenski prsten je vrlo otporan na oksidirajuća sredstva kao što je kalijev permanganat, što također proturječi prisutnosti lokaliziranih dvostrukih veza u benzenu. Posebna, tzv Aromatska svojstva benzena objašnjavaju se činjenicom da su sve veze u njegovoj molekuli poredane, tj. udaljenosti između susjednih atoma ugljika jednake su i jednake 0,14 nm, duljina jednostruke C-C veze je 0,154 nm, a dvostruke C =C veza je 0,132 nm. Molekula benzena ima os simetrije šestog reda; Benzen kao aromatski spoj karakterizira prisutnost seksteta p-elektrona, koji tvore jedan zatvoreni stabilni elektronički sustav. Međutim, još uvijek ne postoji općeprihvaćena formula koja odražava njegovu strukturu; često se koristi formula (2).
Učinak na tijelo
Benzen može izazvati akutno i kronično trovanje. Prodire u tijelo uglavnom kroz dišni sustav, ali se također može apsorbirati kroz neoštećenu kožu. Najveća dopuštena koncentracija para benzena u zraku radnih prostorija je 20 mg/m 3 . Izlučuje se putem pluća i urinom. Do akutnog trovanja obično dolazi tijekom nesreća; njihovi najkarakterističniji znakovi su: glavobolja, vrtoglavica, mučnina, povraćanje, uznemirenost praćena depresivnim stanjem, ubrzan puls, pad krvnog tlaka, u teškim slučajevima - konvulzije, gubitak svijesti. Kronično trovanje benzenom očituje se promjenama u krvi (poremećena funkcija koštane srži), vrtoglavicom, općom slabošću, poremećajem sna, umorom; kod žena - menstrualna disfunkcija. Pouzdana mjera protiv trovanja parama benzena je dobra ventilacija industrijskih prostora.
Liječenje akutnog trovanja: odmor, toplina, bromidni lijekovi, kardiovaskularni lijekovi; za kronično trovanje s teškom anemijom: transfuzija crvenih krvnih stanica, vitamin B12, dodaci željeza.
Izvori
- Omelyanenko L. M., Senkevich N. A., Klinika i prevencija trovanja benzenom, M., 1957;
DEFINICIJA
Benzen(cikloheksatrien - 1,3,5) je organska tvar, najjednostavniji predstavnik niza aromatskih ugljikovodika.
Formula – C 6 H 6 (strukturna formula – sl. 1). Molekularna težina – 78,11.
Riža. 1. Strukturne i prostorne formule benzena.
Svih šest atoma ugljika u molekuli benzena je u sp 2 hibridnom stanju. Svaki atom ugljika tvori 3σ veze s dva druga atoma ugljika i jednim atomom vodika, koji leže u istoj ravnini. Šest atoma ugljika tvori pravilan šesterokut (σ-kostur molekule benzena). Svaki atom ugljika ima jednu nehibridiziranu p orbitalu koja sadrži jedan elektron. Šest p-elektrona tvori jedan oblak π-elektrona (aromatski sustav), koji je prikazan kao krug unutar šesteročlanog prstena. Ugljikovodični radikal dobiven iz benzena naziva se C 6 H 5 - - fenil (Ph-).
Kemijska svojstva benzena
Benzen karakteriziraju reakcije supstitucije koje se odvijaju putem elektrofilnog mehanizma:
- halogeniranje (benzen reagira s klorom i bromom u prisutnosti katalizatora - bezvodni AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 = C6H5-Cl + HCl;
- nitriranje (benzen lako reagira s nitrirajućom smjesom - smjesom koncentrirane dušične i sumporne kiseline)

- alkilacija s alkenima
C6H6 + CH2 = CH-CH3 → C6H5-CH(CH3)2;
Adicijske reakcije na benzen dovode do razaranja aromatskog sustava i javljaju se samo u teškim uvjetima:
— hidrogenacija (reakcija se događa zagrijavanjem, katalizator je Pt)

- adicija klora (događa se pod utjecajem UV zračenja uz nastanak krutog produkta - heksaklorocikloheksan (heksakloran) - C 6 H 6 Cl 6)

Kao i svaki organski spoj, benzen prolazi reakciju izgaranja uz stvaranje ugljičnog dioksida i vode kao produkata reakcije (gori uz dimni plamen):
2C 6 H 6 +15O 2 → 12CO 2 + 6H 2 O.
Fizikalna svojstva benzena
Benzen je bezbojna tekućina, ali ima specifičan oštar miris. S vodom stvara azeotropnu smjesu, dobro se miješa s eterima, benzinom i raznim organskim otapalima. Vrelište – 80,1C, talište – 5,5C. Toksičan, kancerogen (tj. potiče razvoj raka).
Dobivanje i uporaba benzena
Glavne metode dobivanja benzena:
— dehidrociklizacija heksana (katalizatori – Pt, Cr 3 O 2)
CH3-(CH2)4-CH3 → C6H6 + 4H2;
— dehidrogenacija cikloheksana (reakcija se odvija zagrijavanjem, katalizator je Pt)
C6H12 → C6H6 + 4H2;
— trimerizacija acetilena (reakcija se odvija zagrijavanjem na 600C, katalizator je aktivni ugljen)
3HC≡CH → C6H6.
Benzen služi kao sirovina za proizvodnju homologa (etilbenzen, kumen), cikloheksana, nitrobenzena, klorobenzena i drugih tvari. Prethodno se benzen koristio kao dodatak benzinu za povećanje oktanskog broja, ali sada je zbog visoke toksičnosti sadržaj benzena u gorivu strogo reguliran. Benzen se ponekad koristi kao otapalo.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Napiši jednadžbe pomoću kojih se mogu izvesti sljedeće transformacije: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Otopina | Za proizvodnju acetilena iz metana koristi se sljedeća reakcija: 2CH4 → C2H2 + 3H2 (t = 1400C). Proizvodnja benzena iz acetilena moguća je reakcijom trimerizacije acetilena, koja se odvija zagrijavanjem (t = 600C) iu prisutnosti aktivnog ugljena: 3C 2 H 2 → C 6 H 6. Reakcija kloriranja benzena da bi se dobio klorbenzen kao produkt provodi se u prisutnosti željezovog (III) klorida: C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
PRIMJER 2
| Vježbajte | U 39 g benzena u prisutnosti željezovog (III) klorida dodan je 1 mol bromne vode. Koja je količina tvari i koliko grama kojeg proizvoda proizvedena? |
| Otopina | Napišimo jednadžbu za reakciju bromiranja benzena u prisutnosti željezovog (III) klorida: C 6 H 6 + Br 2 → C 6 H 5 Br + HBr. Produkti reakcije su bromobenzen i bromovodik. Molarna masa benzena, izračunata pomoću tablice kemijskih elemenata D.I. Mendeljejev – 78 g/mol. Nađimo količinu benzena: n(C6H6) = m(C6H6)/M(C6H6); n(C6H6) = 39/78 = 0,5 mol. Prema uvjetima zadatka benzen je reagirao s 1 molom broma. Posljedično, benzen je u nedostatku i daljnji izračuni će se raditi pomoću benzena. Prema jednadžbi reakcije n(C 6 H 6): n (C 6 H 5 Br) : n (HBr) = 1:1:1, dakle n(C 6 H 6) = n(C 6 H 5 Br) =: n(HBr) = 0,5 mol. Tada će mase brombenzena i bromovodika biti jednake: m(C6H5Br) = n(C6H5Br)×M(C6H5Br); m(HBr) = n(HBr)×M(HBr). Molarne mase bromobenzena i bromovodika, izračunate pomoću tablice kemijskih elemenata D.I. Mendelejev - 157 odnosno 81 g/mol. m(C6H5Br) = 0,5 x 157 = 78,5 g; m(HBr) = 0,5×81 = 40,5 g. |
| Odgovor | Produkti reakcije su bromobenzen i bromovodik. Mase bromobenzena su 78,5 i bromovodika 40,5 g. |
DEFINICIJA
Benzen- to je bezbojna tekućina karakterističnog mirisa; vrelište 80,1 o C, talište 5,5 o C. Netopljiv u vodi, otrovan.
Aromatska svojstva benzena, određena osobitostima njegove strukture, izražena su u relativnoj stabilnosti benzenskog prstena, unatoč nezasićenom sastavu benzena. Dakle, za razliku od nezasićenih spojeva s etilenskim dvostrukim vezama, benzen je otporan na oksidirajuća sredstva.
Riža. 1. Struktura molekule benzena prema Kekulu.
Dobivanje benzena
Glavne metode dobivanja benzena uključuju:
— dehidrociklizacija heksana (katalizatori - Pt, Cr 3 O 2)
CH3-(CH2)4-CH3 → C6H6 + 4H2 (to C, p, kat = Cr2O3);
— dehidrogenacija cikloheksana
C6H12 → C6H6 + 3H2 (t o C, kat = Pt, Ni);
— trimerizacija acetilena (reakcija se odvija zagrijavanjem na 600 o C, katalizator je aktivni ugljen)
3HC≡CH → C 6 H 6 (t = 600 o C, kat = C aktiv).
Kemijska svojstva benzena
Benzen karakteriziraju reakcije supstitucije koje se odvijaju putem elektrofilnog mehanizma:
Halogeniranje (benzen reagira s klorom i bromom u prisutnosti katalizatora - bezvodni AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 = C6H5-Cl + HCl;
- nitriranje (benzen lako reagira s nitrirajućom smjesom - smjesom koncentrirane dušične i sumporne kiseline)

- alkilacija s alkenima
C 6 H 6 + CH 2 =CH-CH 3 → C 6 H 5 -CH(CH 3) 2
Adicijske reakcije na benzen dovode do razaranja aromatskog sustava i javljaju se samo u teškim uvjetima:
- hidrogenacija (produkt reakcije - cikloheksan)
C6H6 + 3H2 → C6H12 (t o C, kat = Pt);
- adicija klora (događa se pod utjecajem UV zračenja uz nastanak krutog produkta - heksaklorocikloheksan (heksakloran) - C 6 H 6 Cl 6)
C 6 H 6 + 6Cl 2 → C 6 H 6 Cl 6 .
Primjena benzena
Benzen se široko koristi u industrijskoj organskoj kemiji. Gotovo svi spojevi koji sadrže benzenske prstene dobivaju se iz benzena, na primjer, stiren, fenol, anilin, halogenirani areni. Benzen se koristi za sintezu boja, površinski aktivnih tvari i farmaceutskih proizvoda.
Primjeri rješavanja problema
PRIMJER 1
| Vježbajte | Gustoća pare tvari je 3,482 g/l. Njegovom pirolizom dobiveno je 6 g čađe i 5,6 litara vodika. Odredite formulu ove tvari. |
| Otopina | Čađa je ugljik. Nađimo količinu čađave tvari na temelju uvjeta zadatka (molarna masa ugljika je 12 g/mol): n(C) = m(C) / M(C); n(C) = 6/12 = 0,5 mol. Izračunajmo količinu tvari vodika: n(H2) = V(H2)/Vm; n(H2) = 5,6 / 22,4 = 0,25 mol. To znači da će količina tvari jednog atoma vodika biti jednaka: n(H) = 2 × 0,25 = 0,5 mol. Označimo broj atoma ugljika u molekuli ugljikovodika s "x", a broj atoma vodika s "y", tada je omjer tih atoma u molekuli: x: y = 0,5: 0,5 = 1:1. Tada ćemo najjednostavniju formulu ugljikovodika izraziti sastavom CH. Molekularna težina molekule sastava CH jednaka je: M(CH) = 13 g/mol Nađimo molekularnu težinu ugljikovodika na temelju uvjeta problema: M (C x H y) = ρ×V m; M (C x H y) = 3,482 x 22,4 = 78 g/mol. Odredimo pravu formulu ugljikovodika: k= M(C x H y)/ M(CH)= 78/13 =6, stoga je potrebno koeficijente "x" i "y" pomnožiti sa 6 i tada će formula ugljikovodika imati oblik C 6 H 6. Ovo je benzen. |
| Odgovor | Željeni ugljikovodik ima sastav C6H6. Ovo je benzen. |
PRIMJER 2
| Vježbajte | Izračunajte količinu tvari acetilena koja će biti potrebna da se dobije 400 ml benzena (gustoće 0,8 g/ml). |
| Otopina | Napišimo jednadžbu reakcije za proizvodnju benzena iz acetilena: Gospođa Khimiya je konačno i nepovratno stekla takav spoj kao što je benzen tek 1833. godine. Benzen je spoj žestokog, moglo bi se reći i eksplozivnog karaktera. Kako ste to saznali? PričaJohann Glauber 1649. skrenuo je pozornost na spoj koji je uspješno nastao kada je kemičar prerađivao katran ugljena. Ali željelo je ostati inkognito. Otprilike 170 godina kasnije, točnije sredinom dvadesetih godina 19. stoljeća, igrom slučaja, benzen je izdvojen iz svjetlećeg plina, odnosno iz oslobođenog kondenzata. Takve napore čovječanstvo duguje Michaelu Faradayu, znanstveniku iz Engleske. Palicu za nabavu benzena preuzeo je Nijemac Eilgard Mitscherlich. To se dogodilo tijekom obrade bezvodnih kalcijevih soli benzojeve kiseline. Možda je zato spoj dobio takvo ime - benzen. Alternativno, znanstvenik ga je nazvao benzinom. Tamjan, ako se prevede s arapskog. Benzen lijepo i jarko gori; u vezi s tim zapažanjima, Auguste Laurent je preporučio da ga nazovete "fen" ili "benzen". Svijetlo, sjajno - ako je prevedeno s grčkog. Na temelju koncepta prirode elektroničke komunikacije i kvaliteta benzena, znanstvenik je dao molekulu spoja u obliku sljedeće slike. Ovo je šesterokut. U njega je upisana kružnica. Gore navedeno sugerira da benzen ima potpuni elektronski oblak, koji sigurno zatvara šest (bez iznimke) ugljikovih atoma ciklusa. Nisu uočene pričvršćene binarne veze. Benzen se ranije koristio kao otapalo. Ali u biti, kako kažu, nije bio član, nije sudjelovao, nije bio uključen. Ali to je u 19. stoljeću. U 20. stoljeću dogodile su se značajne promjene. Svojstva benzena izražavaju najvrednije osobine koje su mu pomogle da postane popularniji. Oktanski broj, koji se pokazao visokim, omogućio je njegovu upotrebu kao element goriva za punjenje automobila. Ova radnja poslužila je kao poticaj za opsežno povlačenje benzena, njegova ekstrakcija se provodi kao sekundarni proizvod proizvodnje čelika za koksiranje. Do četrdesetih godina benzen se počeo koristiti u kemijskom polju u proizvodnji tvari koje brzo eksplodiraju. 20. stoljeće okrunilo se činjenicom da je industrija rafiniranja nafte proizvela toliko benzena da je počeo opskrbljivati kemijsku industriju. Karakteristike benzenaNezasićeni ugljikovodici vrlo su slični benzenu. Na primjer, niz etilenskih ugljikovodika karakterizira se kao nezasićeni ugljikovodik. Karakterizira ga reakcija adicije. U sve to spremno ulazi benzen zahvaljujući atomima koji se nalaze u istoj ravnini. I kao činjenica - konjugirani elektronski oblak.
Ako je u formuli prisutan benzenski prsten, onda možemo doći do elementarnog zaključka da se radi o benzenu, čija strukturna formula izgleda upravo ovako. Fizička svojstvaBenzen je tekućina koja nema boju, ali ima neugodan miris. Benzen se topi kada temperatura dosegne 5,52 stupnja Celzijusa. Vri na 80,1. Gustoća je 0,879 g/cm 3, molarna masa je 78,11 g/mol. Kod gorenja jako dimi. Ulaskom zraka stvara eksplozivne spojeve. stijene (benzin, eter i druge) se bez problema spajaju s opisanom tvari. S vodom stvara azeotropni spoj. Zagrijavanje prije isparavanja počinje na 69,25 stupnjeva (91% benzena). Na 25 stupnjeva Celzijevih može se otopiti u vodi 1,79 g/l. Kemijska svojstvaBenzen reagira sa sumpornom i dušičnom kiselinom. I također s alkenima, halogenima, kloroalkanima. Za njega je karakteristična reakcija supstitucije. Temperatura tlaka utječe na proboj benzenskog prstena, koji se događa u prilično teškim uvjetima. Svaku jednadžbu reakcije benzena možemo detaljnije razmotriti. 1. Elektrofilna supstitucija. Brom, u prisutnosti katalizatora, reagira s klorom. Kao rezultat, dobivamo klorobenzen: S6H6+3Cl2 → C6H5Cl + HCl 2. Friedel-Craftsova reakcija, odnosno alkilacija benzena. Pojava alkilbenzena nastaje zbog kombinacije s alkanima, koji su derivati halogena: C6H6 + C2H5Br → C6H5C2H5 + HBr 3. Elektrofilna supstitucija. Ovdje se odvija reakcija nitriranja i sulfoniranja. Jednadžba za benzen će izgledati ovako: C6H6 + H2SO4 → C6H5SO3H + H2O C6H6 + HNO3 → C6H5NO2 + H2O 4. Benzen pri gorenju: 2C6H6 + 15O2 → 12CO2 + 6H2O Pod određenim uvjetima, pokazuje svojstva karakteristična za zasićene ugljikovodike. P-elektronski oblak, koji se nalazi u strukturi dotične tvari, objašnjava ove reakcije. Različite vrste benzena ovise o posebnoj tehnologiji. Ovdje je označen naftni benzen. Na primjer, pročišćeni i visoko pročišćeni, za sintezu. Želio bih posebno istaknuti homologe benzena, točnije njihova kemijska svojstva. To su alkilbenzeni.
Homolozi benzena reagiraju mnogo spremnije. Ali gore navedene reakcije benzena, odnosno homologa, odvijaju se s nekim razlikama. Halogeniranje alkilbenzenaOblik jednadžbe je sljedeći: C6H5-CH3 + Br = C6H5-CH2Br + HBr. Tendencija broma u benzenski prsten nije opažena. Izlazi u lanac sa strane. Ali zahvaljujući katalizatoru soli Al(+3), brom lako ulazi u prsten. Nitriranje alkilbenzenaZahvaljujući sumpornoj i dušičnoj kiselini, benzeni i alkilbenzeni se nitriraju. Reaktivni alkilbenzeni. Dobivena su dva od tri prikazana proizvoda - to su para- i orto-izomeri. Možete napisati jednu od formula: C6H5 - CH3 + 3HNO3 → C6H2CH3 (NO2)3. OksidacijaTo je neprihvatljivo za benzen. Ali alkilbenzeni reagiraju lako. Na primjer, benzojeva kiselina. Formula je navedena u nastavku: C6H5CH3 + [O] → C6H5COOH. Alkilbenzen i benzen, njihovo hidrogeniranjeU prisutnosti pojačivača, vodik počinje reagirati s benzenom, što rezultira stvaranjem cikloheksana, kao što je gore objašnjeno. Isto tako, alkilbenzeni se lako pretvaraju u alkilcikloheksane. Za dobivanje alkilcikloheksana potrebno je hidrogenirati željeni alkilbenzen. Ovo je u osnovi neophodan postupak za proizvodnju čistog proizvoda. I to nisu sve reakcije benzena i alkilbenzena. Proizvodnja benzena. IndustrijaTemelj takve proizvodnje temelji se na preradi komponenti: toluena, nafte, katrana koji se oslobađa tijekom krekiranja ugljena i drugih. Stoga se benzen proizvodi u petrokemijskim i metalurškim poduzećima. Važno je znati kako dobiti benzen različitih stupnjeva čistoće, jer princip proizvodnje i svrha izravno ovise o marki ove tvari. Lavovski udio proizvodi se termokatalitičkim reformiranjem kaustobiolitnog dijela, vrenjem na 65 stupnjeva, s ekstraktnim učinkom, destilacijom s dimetilformamidom. Pri proizvodnji etilena i propilena dobivaju se tekući produkti koji nastaju pri razgradnji anorganskih i organskih spojeva pod utjecajem topline. Iz njih se izdvaja benzen. Ali, nažalost, nema toliko izvornog materijala za ovu opciju za ekstrakciju benzena. Stoga se tvar koja nas zanima ekstrahira reformingom. Ovom metodom povećava se volumen benzena.
Dealkilacijom na temperaturi od 610-830 stupnjeva s predznakom plus, u prisutnosti pare nastale vrenjem vode i vodika, iz toluena se dobiva benzen. Postoji još jedna opcija - katalitička. Kada se promatra prisutnost zeolita ili, alternativno, oksidnih katalizatora, podliježe temperaturnom režimu od 227-627 stupnjeva. Postoji još jedna, starija metoda za razvijanje benzena. Uz pomoć apsorpcije apsorbentima organskog podrijetla izdvaja se iz konačnog rezultata koksnog ugljena. Proizvod je parno-plinski proizvod i prethodno je ohlađen. Na primjer, koristi se nafta čiji je izvor nafta ili ugljen. Kada se destilacija provodi vodenom parom, apsorbens se odvaja. Hidroobrada pomaže u uklanjanju viška tvari iz sirovog benzena. Sirovine ugljenaU metalurgiji se korištenjem ugljena, točnije suhom destilacijom, dobiva koks. Tijekom ovog postupka dovod zraka je ograničen. Ne zaboravite da se ugljen zagrijava na temperaturu od 1200-1500 Celzija. Kemijski benzen iz ugljena treba temeljito pročišćavanje. Imperativ je riješiti se metil cikloheksana i njegovog prijatelja n-heptana. također treba oduzeti. Benzen se suočava s procesom odvajanja i pročišćavanja koji će se provoditi više puta. Gore opisana metoda je najstarija, ali s vremenom gubi svoju visoku poziciju. Frakcije nafte0,3-1,2% - ovo su pokazatelji sastava našeg heroja u sirovoj nafti. Oskudni pokazatelji za ulaganje novca i truda. Najbolje je koristiti industrijski postupak za preradu naftnih frakcija. To jest, katalitički reforming. U prisutnosti aluminij-platina-renijevog pojačivača povećava se postotak aromatskih ugljikohidrata, a povećava se i pokazatelj koji određuje sposobnost goriva da se spontano ne zapali tijekom kompresije. Pirolizne smoleAko naše naftne derivate izdvajamo iz nekrutih sirovina, odnosno pirolizom propilena i etilena koji nastaju tijekom proizvodnje, onda će ovaj pristup biti najprihvatljiviji. Točnije, iz pirokondenzata se oslobađa benzen. Razgradnja određenih omjera zahtijeva hidrotretiranje. Tijekom čišćenja uklanjaju se sumpor i nezasićene smjese. Početni rezultat sadržavao je ksilen, toluen i benzen. Korištenjem destilacije, koja je ekstrakcijska, BTK skupina se odvaja za proizvodnju benzena.
Hidrodealkilacija toluenaGlavni elementi procesa, koktel protoka vodika i toluena, uvode se zagrijani u reaktor. Toluen prolazi kroz sloj katalizatora. Tijekom ovog procesa, metilna skupina se odvaja kako bi se formirao benzen. Ovdje je prikladna određena metoda čišćenja. Rezultat je vrlo čista tvar (za nitriranje). Disproporcioniranje toluenaKao rezultat odbacivanja klase metila, dolazi do stvaranja benzena, a ksilen se oksidira. Transalkilacija je uočena u ovom procesu. Katalitički učinak nastaje zahvaljujući paladiju, platini i neodimiju koji se nalaze na aluminijevom oksidu. Taluen i vodik se dovode u reaktor sa stabilnim slojem katalizatora. Njegova je svrha spriječiti taloženje ugljikovodika na ravninu katalizatora. Struja koja napušta reaktor se hladi, a vodik se sigurno prikuplja za recikliranje. Ono što ostane destilira se tri puta. U početnoj fazi uklanjaju se nearomatski spojevi. Drugo se ekstrahira benzen, a posljednji korak je odvajanje ksilena. Trimerizacija acetilenomZahvaljujući radu francuskog fizikalnog kemičara Marcelina Berthelota, benzen se počeo proizvoditi iz acetilena. Ali ono što se isticalo bio je težak koktel mnogih drugih elemenata. Pitanje je bilo kako sniziti temperaturu reakcije. Odgovor je dobio tek kasnih četrdesetih godina 20. stoljeća. V. Reppe pronašao je odgovarajući katalizator, pokazalo se da je to nikal. Trimerizacija je jedina mogućnost dobivanja benzena iz acetilena.
Benzen se dobiva pomoću aktivnog ugljena. Pri visokim razinama topline acetilen prelazi preko ugljena. Benzen se oslobađa ako je temperatura najmanje 410 stupnjeva. Istodobno se rađaju i različiti aromatski ugljikovodici. Stoga vam je potrebna dobra oprema koja može učinkovito očistiti acetilen. Uz tako radno intenzivnu metodu kao što je trimerizacija, troši se puno acetilena. Da biste dobili 15 ml benzena, uzmite 20 litara acetilena. Možete vidjeti kako to izgleda i reakcija neće dugo trajati. 3C2H2 → C6H6 (Zelinskijeva jednadžba). 3CH → CH = (t, kat) = C6H6. Gdje se koristi benzen?Benzen je prilično popularno dijete kemije. Posebno se često primjećivalo kako se benzen koristio u proizvodnji kumena, cikloheksana i etilbenzola. Za stvaranje stirena ne možete bez etilbenzena. Polazni materijal za proizvodnju kaprolaktama je cikloheksan. Za izradu termoplastične smole koristi se kaprolaktam. Opisana tvar nezamjenjiva je u proizvodnji raznih boja i lakova. Koliko je benzen opasan?Benzen je otrovna tvar. Manifestacija osjećaja malaksalosti, koja je popraćena mučninom i jakom vrtoglavicom, znak je trovanja. Ne može se isključiti ni smrt. Osjećaj neopisivog užitka nije ništa manje alarmantno zvono za trovanje benzenom. Benzen u tekućem obliku izaziva iritaciju kože. Pare benzena lako prodiru čak iu netaknutu kožu. Uz vrlo kratkotrajne kontakte s tvari u malim dozama, ali redovito, neugodne posljedice neće dugo čekati. To može biti oštećenje koštane srži i akutna leukemija različitih vrsta.
Osim toga, tvar uzrokuje ovisnost kod ljudi. Benzen djeluje kao droga. Duhanski dim proizvodi produkt sličan katranu. Kada su ga proučavali, došli su do zaključka da njegov sadržaj nije siguran za ljude. Osim prisutnosti nikotina, otkrivena je i prisutnost aromatičnih ugljikohidrata poput benzpirena. Posebnost benzopirena je da je kancerogen. Imaju vrlo štetan učinak. Na primjer, uzrokuju rak. Unatoč navedenom, benzen je polazna sirovina za proizvodnju raznih lijekova, plastike, sintetičkog kaučuka i, naravno, boja. Ovo je najčešća zamisao kemije i aromatski spoj. Udio
|