Mai sus, compușii aromatici au fost definiți ca compuși care seamănă cu benzenul. Dar ce proprietăți specifice ale benzenului trebuie să aibă un compus pentru ca acesta să fie clasificat ca aromatic? Pe lângă compușii care conțin inele benzenice, există multe alte substanțe care sunt numite aromatice, deși unele dintre ele seamănă puțin cu benzenul ca aspect.
Ce proprietăți sunt caracteristice tuturor compușilor aromatici?
Din punct de vedere empiric, compușii aromatici sunt compuși a căror formulă moleculară corespunde unui grad ridicat de nesaturare și care, totuși, nu suferă reacțiile de adiție caracteristice de obicei compușilor nesaturați. În loc de reacții de adiție, acești compuși aromatici adesea, ca benzenul, suferă reacții de substituție electrofilă. Odată cu reacțiile de inerție în plus, se manifestă și stabilitatea neobișnuită a acestor compuși - valori scăzute ale căldurilor de hidrogenare și ardere. Compușii aromatici au o structură ciclică - de obicei care conține inele cu cinci, șase sau șapte membri - și atunci când sunt studiați prin metode fizice se constată că moleculele lor sunt plate (sau aproape plate). Protonii din acești compuși au aproximativ aceleași valori de deplasare chimică în spectrele RMN (secțiunea 13.18) ca protonii din benzen și derivații săi.
Din punct de vedere teoretic, pentru ca un compus să fie aromatic, molecula lui trebuie să conţină un sistem ciclic de electroni delocalizaţi deasupra şi sub planul moleculei; Mai mult decât atât, norul de -electroni trebuie să conțină -electroni. Cu alte cuvinte, pentru gradul de stabilitate care este caracteristic compușilor aromatici, delocalizarea singură nu este suficientă. Molecula trebuie să conțină un număr strict definit de electroni - 2, sau 6, sau 10 etc. Această cerință, cunoscută sub numele de regula sau regula Hückel (numită după Erich Hückel, Institutul pentru Fizică Teoretică, Stuttgart), se bazează pe mecanica cuanticăși este asociat cu cerințele de umplere a diferiților orbitali care formează -norul. Valabilitatea regulii lui Hückel este bine confirmată de fapte.
Să ne uităm la câteva date care confirmă regula lui Hückel. Benzenul are șase electroni, un sextet aromatic; numărul șase este numărul Hückel pentru Pe lângă benzen și substanțe similare (naftalină, antracen, fenantren, capitolul 35), ne vom întâlni și un număr mare compuși heterociclici care au proprietăți aromatice distincte; după cum se va arăta, la similar
Heterodiculii aromatici includ acei compuși în care poate apărea un sextet aromatic.
Ca alte exemple, luați în considerare următorii șase compuși, fiecare dintre care are o singură structură de rezonanță:

Fiecare moleculă este un hibrid de cinci sau șase structuri echivalente care conțin o sarcină sau un electron nepereche pe fiecare dintre atomii de carbon. Cu toate acestea, dintre acești șase compuși, doar doi sunt neobișnuit de stabili: anionul ciclopentadienil și cationul cicloheptatrienil (ionul de tropiliu).
Ciclopentadiena este un acid neobișnuit de puternic pentru o hidrocarbură, indicând o stabilitate crescută a anionului format atunci când un ion de hidrogen este extras. (Ciclopentadiena este un acid mult mai puternic decât cicloheptatriena, deși anionul acestuia din urmă este stabilizat prin rezonanța a șapte structuri.) Diciclopentadienilironul (ferocenul) este o moleculă stabilă având o structură tip sandwich în care atomul de fier este prins între două inele cu cinci membri. Toate legăturile carbon-carbon au o lungime de 1,4 A. Inelele de ferocen suferă reacții tipice de substituție aromatică - sulfonare și reacția Friedel-Crafts.

Dintre derivații de cicloheptatrienil, este cationul care are proprietăți neobișnuite. Bromura de tropil se topește, este foarte solubilă în apă, dar este insolubilă în solvenți nepolari și precipită instantaneu la acțiune. Acest comportament este neobișnuit pentru o bromură organică și sugerează că, chiar și în stare solidă, se are de-a face cu un compus ionic în care cationul este de fapt un ion de carboniu stabil.
Să luăm în considerare configuratie electronica anion ciclopentadienil (fig. 10.5). Fiecare atom de carbon este hibridizat trigonal și legat prin legături la alți doi atomi de carbon și un atom de hidrogen. Inelul anionului ciclopentadienil este un pentagon regulat, ale cărui unghiuri sunt ; o anumită instabilitate rezultată din suprapunerea imperfectă (stresul unghiular) este mai mult decât compensată de delocalizarea rezultată. Patru atomi de carbon au câte un electron în fiecare -orbital, al cincilea atom de carbon (cel care și-a pierdut un proton, dar în realitate, desigur, imposibil de distins de ceilalți) are o pereche de electroni.

Orez. 10.5. Anion ciclopentadienil. a - doi electroni în orbitalul a unuia dintre atomii de carbon, un electron în orbitalii fiecăruia dintre ceilalți atomi de carbon; b - suprapunerea -orbitalilor cu formarea de legături -; c - nori deasupra sau sub planul inelului; există doar șase electroni, adică un sextet aromatic.
Suprapunerea orbitalilor duce la formarea de nori care conțin un total de șase electroni, adică un sextet aromatic.
Configurația ionului de tropil este descrisă într-un mod similar. Este un heptagon regulat (unghiuri egale cu 128,5° (2,242 rad)]. Sase atomi de carbon au fiecare un electron, iar al saptelea are doar un orbital gol. Rezultatul este un sextet aromatic.
Ionii considerați sunt reprezentați cel mai convenabil după cum urmează:

Cele mai comune sisteme sunt cele cu un număr Hückel de șase, ceea ce este de înțeles. Pentru ca atomii unui inel aromatic să aibă -orbitali, ei trebuie să fie în -hibridare și, prin urmare, în mod ideal, unghiurile de legătură ar trebui să fie egale pentru ca suprapunerea orbitalilor - să fie posibilă, ducând la formarea unui -nor, compusul aromatic trebuie sa fie plan sau aproape plan . Numărul de atomi hibridizați trigonal care pot forma un inel plan fără prea multă solicitare unghiulară este de cinci, șase sau șapte și doar un inel plan permite o suprapunere suficientă pentru a forma o legătură. Numărul Hückel de șase corespunde numărului de electroni care pot fi furnizați sistem comun numărul specificat de atomi în inel. (Nu este o coincidență că benzenul, un exemplu de compus aromatic, este și el o structură ideală: conține șase atomi capabili să doneze șase electroni și să formeze un hexagon, ale cărui unghiuri sunt exact trigonale.)
Să luăm acum în considerare ce dovezi există că alte numere Hückel sunt, de asemenea, „numere magice”? În aceste cazuri nu se poate aștepta ca caracterul aromatic să se manifeste în mod necesar într-o stabilitate extremă a compușilor comparabilă cu cea a benzenului și a compușilor înrudiți. Inelele cu acest număr de atomi de carbon vor fi prea mici sau prea mari pentru a găzdui bine atomii de carbon hibridizați trigonal. Prin urmare, orice stabilizare datorată aromaticității poate fi compensată în mare măsură prin stres unghiular sau. grad scăzut de suprapunere a -orbitalilor sau ambilor factori.
Stabilitatea ar trebui luată în considerare doar într-un sens comparativ, așa cum s-a făcut mai sus pentru derivații de ciclopentadienil și cicloheptatrienil, iar dovezile de aromaticitate trebuie văzute în faptul că una sau alta moleculă este mai stabilă decât cele înrudite. Regula a fost pe deplin confirmată experimental. Obiectivul actual al cercetării este de a clarifica o întrebare mai complexă și anume: la ce combinație maximă nefavorabilă de stres unghiular și repulsii electrostatice din cauza prezenței sarcinilor multiple se mai poate observa manifestarea aromaticității?
(vezi scanare)
Hidrocarburi aromatice- compuși ai carbonului și hidrogenului, a căror moleculă conține un inel benzenic. Cei mai importanți reprezentanți ai hidrocarburilor aromatice sunt benzenul și omologii săi - produse ale înlocuirii unuia sau mai multor atomi de hidrogen într-o moleculă de benzen cu reziduuri de hidrocarburi.

Structura moleculei de benzen
Primul compus aromatic, benzenul, a fost descoperit în 1825 de M. Faraday. Formula sa moleculară a fost stabilită - C6H6. Dacă comparăm compoziția sa cu compoziția unei hidrocarburi saturate care conține același număr de atomi de carbon - hexan (C 6 H 14), atunci putem observa că benzenul conține opt atomi de hidrogen mai puțini. După cum se știe, apariția legăturilor și a ciclurilor multiple duce la o scădere a numărului de atomi de hidrogen dintr-o moleculă de hidrocarbură. În 1865, F. Kekule a propus formula sa structurală ca ciclohexanthriene-1,3,5.

Astfel, o moleculă corespunzătoare formulei Kekulé conține legături duble, prin urmare, benzenul trebuie să fie nesaturat, adică să sufere ușor reacții de adiție: hidrogenare, bromurare, hidratare etc.

Cu toate acestea, datele din numeroase experimente au arătat că benzenul suferă reacții de adiție numai în condiții dure(la temperaturi ridicate și la iluminare), rezistent la oxidare. Cele mai caracteristice reacții pentru acesta sunt reacțiile de substituție Prin urmare, benzenul are un caracter mai apropiat de hidrocarburile saturate.
În încercarea de a explica aceste discrepanțe, mulți oameni de știință au propus diverse opțiuni structura benzenului. Structura moleculei de benzen a fost în cele din urmă confirmată de reacția de formare a acesteia din acetilenă. În realitate, legăturile carbon-carbon din benzen sunt echivalente, iar proprietățile lor nu sunt similare cu cele ale legăturilor simple sau duble.
În prezent, benzenul este notat fie prin formula Kekule, fie printr-un hexagon în care este reprezentat un cerc.

Deci, ce este special la structura benzenului?
Pe baza datelor cercetării și a calculelor, s-a ajuns la concluzia că toți cei șase atomi de carbon sunt într-o stare de hibridizare sp 2 și se află în același plan. Orbitalii p nehibridați ai atomilor de carbon care formează legăturile duble (formula Kekule) sunt perpendiculari pe planul inelului și paraleli unul cu celălalt.
Se suprapun unul pe altul, formând un singur sistem π. Astfel, sistemul de legături duble alternante descris în formula lui Kekulé este un sistem ciclic de legături π conjugate, suprapuse. Acest sistem constă din două regiuni toroidale (asemănătoare unei gogoși) de densitate electronică situate de fiecare parte a inelului benzenic. Astfel, este mai logic să descriem benzenul ca un hexagon regulat cu un cerc în centru (sistemul π) decât ca ciclohexanthriene-1,3,5.
Omul de știință american L. Pauling a propus să reprezinte benzenul sub forma a două structuri de limită care diferă în distribuția densității electronilor și se transformă constant una în alta:

Măsurătorile lungimii legăturilor confirmă această ipoteză. S-a descoperit că toate legăturile C-C din benzen au aceeași lungime (0,139 nm). Sunt puțin mai scurte decât cele singure Conexiuni C-C(0,154 nm) și mai lungi decât cele duble (0,132 nm).
Există, de asemenea, compuși ale căror molecule conțin mai multe structuri ciclice, de exemplu:

Izomeria și nomenclatura hidrocarburilor aromatice
Pentru omologii benzenului izomeria poziţiei mai multor substituenţi este caracteristică. Cel mai simplu omolog al benzenului este toluen(metilbenzen) - nu are astfel de izomeri; următorul omolog este prezentat ca patru izomeri:

Baza denumirii unei hidrocarburi aromatice cu substituenți mici este cuvântul benzen. Atomii din ciclul aromatic sunt numerotați, începând de la senior adjunct până la junior:

Dacă substituenții sunt aceiași, atunci numerotarea se efectuează pe calea cea mai scurtă: de exemplu, substanță:

numit 1,3-dimetilbenzen, nu 1,5-dimetilbenzen.
Conform vechii nomenclaturi, pozițiile 2 și 6 se numesc ortopoziții, 4 - para-poziții, 3 și 5 - meta-poziții.


Proprietățile fizice ale hidrocarburilor aromatice
Benzenul și cei mai simpli omologi ai săi în condiții normale - lichide foarte toxice cu un miros neplăcut caracteristic. Se dizolvă slab în apă, dar bine în solvenți organici.
Proprietățile chimice ale hidrocarburilor aromatice

Reacții de substituție. Hidrocarburile aromatice suferă reacții de substituție.
1. Bromurare. Când reacționează cu brom în prezența unui catalizator, bromură de fier (III), unul dintre atomii de hidrogen din inelul benzenic poate fi înlocuit cu un atom de brom:

2. Nitrarea benzenului și a omologilor săi. Când o hidrocarbură aromatică reacţionează cu acidul azotic în prezenţa acidului sulfuric (un amestec de sulfuric şi acizi azotici numit amestec de nitrare), atomul de hidrogen este înlocuit cu o grupare nitro - NO 2:

Prin reducerea nitrobenzenului obținem anilină- o substanță care este utilizată pentru obținerea coloranților de anilină:

Această reacție poartă numele chimistului rus Zinin.
Reacții de adaos. Compușii aromatici pot suferi, de asemenea, reacții de adiție la inelul benzenic. În acest caz, se formează ciclohexan și derivații săi.
1. Hidrogenarea. Hidrogenarea catalitică a benzenului are loc la o temperatură mai mare decât hidrogenarea alchenelor:

2. Clorarea. Reacția are loc atunci când este iluminată cu lumină ultravioletă și este radicală liberă:

Proprietățile chimice ale hidrocarburilor aromatice - rezumat



Omologuri benzenului
Compoziția moleculelor lor corespunde formulei CnH2n-6. Cei mai apropiați omologi ai benzenului sunt:
Toți omologii benzenului după toluen au izomerii. Izomeria poate fi asociată atât cu numărul și structura substituentului (1, 2), cât și cu poziția substituentului în ciclul benzenic (2, 3, 4). Conexiuni formula generala C 8 H 10 :

Conform vechii nomenclaturi utilizate pentru a indica locația relativă a doi substituenți identici sau diferiți pe inelul benzenic, se folosesc prefixele orto-(abreviat o-) - substituenții sunt localizați pe atomii de carbon vecini, meta-(m-) - printr-un atom de carbon și pereche-(n-) - substituenți opuși unul altuia.
Primii membri ai seriei omoloage de benzen sunt lichide cu un miros specific. Sunt mai ușoare decât apa. Sunt solvenți buni. Omologii benzenului suferă reacții de substituție:
bromurare:

nitrare:

Toluenul este oxidat de permanganat atunci când este încălzit:

Material de referință pentru susținerea testului:
Tabel periodic
Tabelul de solubilitate
ORENES
Hidrocarburi aromatice (arene) – hidrocarburi ciclice, unite prin conceptul de aromaticitate, care determină semne generaleîn structură și proprietăți chimice.
Clasificare
Pe baza numărului de inele benzenice din moleculă, arenele sunt împărțite în la:
mononucleare
multi-core

Nomenclatură și izomerie
Strămoșul structural al hidrocarburilor din seria benzenului este benzen C6H6 din care derivă denumirile sistematice ale omologilor.
Pentru compușii monociclici, se păstrează următoarele denumiri nesistematice (triviale):

Poziția substituenților este indicată cu cele mai mici numere (direcția numerotării nu contează),
|
|
|
iar pentru compușii disubstituiți puteți folosi notația orto, meta, pereche.
|
|
|
|
Dacă există trei substituenți în inel, ei ar trebui să primească cele mai mici numere, adică rândul „1,2,4” are un avantaj față de „1,3,4”.


1,2-dimetil-4-etilbenzen (denumire corectă) 3,4-dimetil-1-etilbenzen (denumire incorectă)
Izomeria arenelor monosubstituite se datorează structurii scheletului de carbon al substituentului în omologii benzenului di- și polisubstituit, se adaugă izomerie suplimentară, cauzată de aranjarea diferită a substituenților în nucleu.
Izomeria hidrocarburilor aromatice cu compoziția C 9 H 12:
|
|
|
|
|
Proprietăți fizice
Punctele de fierbere și de topire ale arenelor sunt mai mari decât cele ale alcanilor, alchenelor, alchinelor, sunt ușor polari, insolubile în apă și foarte solubile în solvenți organici nepolari. Arenele sunt lichide sau solide care au mirosuri specifice. Benzenii și multe arene condensate sunt toxice, unele dintre ele prezintă proprietăți cancerigene. Produșii intermediari ai oxidării arenelor condensate în organism sunt epoxizii, care fie provoacă în mod direct cancer, fie sunt precursori ai agenților cancerigeni.
Obținerea de arene
Multe hidrocarburi aromatice au importante semnificație practicăși sunt produse la scară industrială largă. O serie de metode industriale se bazează pe prelucrarea cărbunelui și petrolului.
Uleiul este format în principal din hidrocarburi alifatice și aliciclice pentru a transforma hidrocarburile alifatice sau aciclice în cele aromatice, au fost dezvoltate metode de aromatizare a uleiului, a căror bază chimică a fost dezvoltată de N.D. Zelinsky, B.A. Kazansky.
1. Ciclizare și dehidrogenare:
2. Hidrodesmetilarea:

3. Omologii benzenului sunt preparați prin alchilare sau acilare urmată de reducerea grupării carbonil.
a) alchilare Friedel-Crafts:

b) Acilare Friedel-Crafts:

4. Prepararea bifenilului prin reacția Wurtz-Fitting:
5. Prepararea difenilmetanului prin reacția Friedel-Crafts:
Structura si proprietăți chimice.
Criterii de aromatitate:
Pe baza calculelor teoretice și a studiilor experimentale ale sistemelor conjugate ciclice, s-a constatat că un compus este aromatic dacă are:
- σ-schelet ciclic plat;
- Conjugați π închis -sistem electronic, care acoperă toți atomii ciclului și care conține 4n + 2, unde n = 0, 1, 2, 3 etc. Această formulare este cunoscută ca regula lui Hückel.
Criteriile de aromaticitate permit să se distingă sistemele aromatice conjugate de toate celelalte. Benzenul conține un sextet de electroni π și urmează regula lui Hückel la n = 1.
Ce dă aromaticitatea:
În ciuda gradului ridicat de nesaturare, compușii aromatici sunt rezistenți la agenții oxidanți și la temperatură și sunt mai predispuși să sufere reacții de substituție, mai degrabă decât reacții de adiție. Acești compuși au stabilitate termodinamică crescută, care este asigurată de energia mare de conjugare a sistemului inelar aromatic (150 kJ/mol, prin urmare, arenele intră de preferință în reacții de substituție, în urma cărora păstrează aromaticitatea);
Mecanismul reacțiilor de substituție electrofilă în ciclul aromatic:
Densitatea electronică a sistemului π-conjugat al inelului benzenic este o țintă convenabilă pentru atacul de către reactivii electrofili.
De obicei, reactivii electrofili sunt generați în timpul unei reacții folosind catalizatori și condiții adecvate.
E – Y → E δ + – Y δ - → E + + Y - Formarea unui complex π. Atacul inițial de către electrofil al norului de electroni π al inelului duce la coordonarea reactivului cu sistemul π și la formarea unui complex de tip donor-acceptor numitπ-complex.

Sistemul de aromă nu este perturbat: Formarea complexului σ. Etapa limitativă, în care electrofilul formează o legătură covalentă cu un atom de carbon datorită a doi electroni ai sistemului π al inelului, care este însoțită de tranziția acestui atom de carbon de la sp 2 - V sp 3 -

stare hibridă și perturbare aromatică, molecula se transformă într-un carbocation.

Stabilizarea complexului σ. Se realizează prin abstracția unui proton din complexul σ folosind o bază. În acest caz, datorită celor doi electroni ai ruperii legăturii covalente C–H, sistemul π închis al inelului este restaurat, adică. molecula revine la starea aromatică:
Substituenții de pe inelul benzenic perturbă uniformitatea distribuției π- nor de electroni al inelului și influențează astfel reactivitatea inelului.
- Substituenții donatori de electroni (D) măresc densitatea de electroni a inelului și cresc rata de substituție electrofilă se numesc astfel de substituenți activând.
- Substituenții atrăgătoare de electroni (A) scad densitatea de electroni a inelului și reduc viteza de reactie, sunt numite decontaminant.
Sistemele conjugate ciclice sunt de mare interes ca grup de compuși cu stabilitate termodinamică crescută în comparație cu sistemele deschise conjugate. Acești compuși au și alte proprietăți speciale, a căror totalitate este combinată concept general aromaticitate. Acestea includ capacitatea unor astfel de compuși nesaturați formal de a suferi reacții de substituție mai degrabă decât de adiție, rezistența la agenți de oxidare și temperatură.
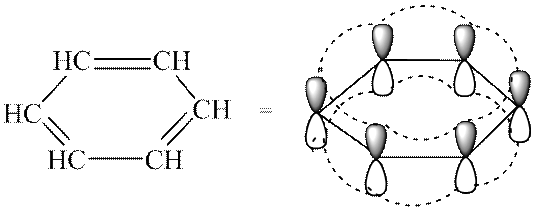
Reprezentanții tipici ai sistemelor aromatice sunt arenele și derivații acestora. Caracteristicile structurii electronice a hidrocarburilor aromatice se manifestă clar în modelul orbital atomic al moleculei de benzen. Cadrul benzenic este format din șase atomi de carbon hibridizați sp 2. Toate legăturile σ (C-C și C-H) se află în același plan. Șase p-AO nehibridate sunt situate perpendicular pe planul moleculei și paralele între ele (Fig. 3a). Fiecare r-AO se poate suprapune în mod egal cu două învecinate r-AO. Ca urmare a unei astfel de suprapuneri, apare un singur sistem π delocalizat, cea mai mare densitate de electroni în care este situată deasupra și sub planul scheletului σ și acoperă toți atomii de carbon ai ciclului (vezi Fig. 3, b) . Densitatea π-electronului este distribuită uniform în întregul sistem ciclic, ceea ce este indicat printr-un cerc sau o linie punctată în interiorul ciclului (vezi Fig. 3, c). Toate legăturile dintre atomii de carbon din ciclul benzenic au aceeași lungime (0,139 nm), intermediară între lungimile legăturilor simple și duble.
Pe baza calculelor mecanice cuantice, s-a stabilit că pentru formarea unor astfel de molecule stabile, un sistem ciclic plat trebuie să conţină (4n + 2) electroni π, unde n= 1, 2, 3 etc. (regula lui Hückel, 1931). Luând în considerare aceste date, poate fi specificat conceptul de „aromaticitate”.
Sisteme de aromă (molecule)– sisteme care se întâlnesc criterii de aromaticitate :
1) prezenţa unui schelet σ plat format din atomi sp 2 -hibridaţi;
2) delocalizarea electronilor, ducând la formarea unui singur nor de electroni π care acoperă toți atomii ciclului (ciclurilor);
3) respectarea regulii lui E. Hückel, i.e. norul de electroni ar trebui să conțină 4n+2 π-electroni, unde n=1,2,3,4... (de obicei numărul indică numărul de cicluri din moleculă);
4) grad înalt stabilitate termodinamică (energie mare de conjugare).
Orez. 3. Modelul orbital atomic al moleculei de benzen (atomi de hidrogen omiși; explicație în text)
Stabilitatea sistemelor cuplate. Formarea unui sistem conjugat și mai ales aromatic este un proces favorabil energetic, deoarece acesta crește gradul de suprapunere a orbitalilor și are loc delocalizarea (dispersia). r-electroni. În acest sens, sistemele conjugate și aromatice au stabilitate termodinamică crescută. Ele conțin o cantitate mai mică de energie internă și în starea fundamentală ocupă o cantitate mai mică nivelul de energie comparativ cu sistemele necuplate. Din diferența dintre aceste niveluri, se poate cuantifica stabilitatea termodinamică a compusului conjugat, adică, energia de conjugare (energie de delocalizare). Pentru butadiena-1,3 este mic și se ridică la aproximativ 15 kJ/mol. Pe măsură ce lungimea lanțului conjugat crește, energia de conjugare și, în consecință, stabilitatea termodinamică a compușilor crește. Energia de conjugare pentru benzen este mult mai mare și se ridică la 150 kJ/mol.
Exemple de compuși aromatici non-benzenoizi:
Piridină De structura electronica seamana cu benzenul. Toți atomii de carbon și atomul de azot sunt într-o stare de hibridizare sp 2, iar toate legăturile σ (C-C, C-N și C-H) se află în același plan (Fig. 4, a). Dintre cei trei orbitali hibrizi ai atomului de azot, doi sunt implicați în formare
Orez. 4. Atom de azot piridin (O), (b)și sistem conjugat în molecula de piridină (c) ( Conexiuni S-N a omis pentru a simplifica figura)
Legături σ cu atomii de carbon (sunt prezentate doar axele acestor orbitali), iar al treilea orbital conține o pereche de electroni singuratică și nu este implicat în formarea legăturii. Se numește un atom de azot cu această configurație electronică piridină.
Datorită electronului situat în orbitalul p nehibridizat (vezi Fig. 4, b), atomul de azot participă la formarea unui singur nor de electroni cu r-electroni cu cinci atomi de carbon (vezi Fig. 4, c). Astfel, piridina este un sistem π,π-conjugat și îndeplinește criteriile de aromaticitate.
Ca urmare a electronegativității mai mari în comparație cu atomul de carbon, atomul de azot piridinic scade densitatea electronilor pe atomii de carbon ai inelului aromatic, prin urmare sistemele cu un atom de azot piridinic se numesc π-insuficient. Pe lângă piridină, un exemplu de astfel de sisteme este pirimidină, care conține doi atomi de azot de piridină.
Pirol se referă și la compuși aromatici. Atomii de carbon și azot din acesta, ca și în piridină, sunt într-o stare de hibridizare sp2. Cu toate acestea, spre deosebire de piridină, atomul de azot din pirol are o configurație electronică diferită (Fig. 5, a, b).
Orez. 5. Atom de azot pirol (O), distribuția electronilor între orbiti (b)și sistemul conjugat din molecula de pirol (c) (legăturile C-H sunt omise pentru a simplifica figura)
Pe nehibridizat r Orbitul - al atomului de azot conține o singură pereche de electroni. Ea este implicată în împerechere cu r-electroni cu patru atomi de carbon pentru a forma un singur nor cu șase electroni (vezi Fig. 5, c). Trei orbitali hibrizi sp 2 formează trei legături σ - doi cu atomi de carbon, unul cu un atom de hidrogen. Atomul de azot în această stare electronică se numește pirol.
Nor cu șase electroni în pirol datorită p,p-conjugarea este delocalizată pe cinci atomi în ciclu, deci pirolul este π-exces sistem.
ÎN furanŞi tiofen sextetul aromatic include, de asemenea, o pereche singură de electroni din p-AO nehibridizat de oxigen sau, respectiv, sulf. ÎN imidazolŞi pirazol Cei doi atomi de azot au contribuții diferite la formarea unui nor de electroni delocalizat: atomul de azot pirol furnizează o pereche de electroni π, iar atomul de azot piridinic furnizează un electron p.
Are și proprietăți aromatice purine, reprezentând un sistem condensat de doi heterocicli - pirimidină și imidazol.
Norul de electroni delocalizat din purină include 8 π electroni cu legături duble și o pereche de electroni singură de la atomul N=9. Numărul total de electroni în conjugare, egal cu zece, corespunde formulei Hückel (4n + 2, unde n = 2).
Compușii aromatici heterociclici au stabilitate termodinamică ridicată. Nu este surprinzător faptul că acestea servesc ca unități structurale ale celor mai importanți biopolimeri - acizii nucleici.
În chimia organică, un astfel de concept ca aromaticitate unii compuși organici. Termenul „aromaticitate” este asociat în primul rând cu benzenul, omologii săi și numeroși derivați. Acest termen se referă exclusiv la structura moleculelor acestor substanțe, proprietățile lor, dar nu are nimic de-a face cu mirosul lor. Adevărat, primii compuși aromatici aveau probabil un miros plăcut (unii eteri naturali, rășini parfumate, precum tămâia etc.).
Aromaticitate - o caracteristică comună a unor compuși organici ciclici care au un set de proprietăți speciale.
Prezența unui singur sistem închis de electroni π într-o moleculă - semnul principal de aromaticitate.
Compușii aromatici respectă regula E. Hückel (1931):
Compușii monociclici plani care au un sistem conjugat de electroni π pot fi aromatici dacă numărul acestor electroni este 4n+2 (unde n = 0,1,2,3, 4 etc., adică numărul de electroni π dintr-o moleculă poate fi 2, 6, 10, 14, 18 etc.).
Aceste caracteristici determină toate cele mai importante proprietăți fizice și chimice ale compușilor aromatici. De exemplu, ei suferă mai degrabă reacții de substituție (în principal electrofile) decât reacții de adiție (în ciuda nesaturației formale). Compușii aromatici sunt foarte rezistenți, de exemplu, la agenții oxidanți. Moleculele lor au o structură plată. Dacă această cerință nu este îndeplinită, atunci paralelismul axelor orbitalilor 2p din moleculă este perturbat, ceea ce duce la eliminarea conjugării și, în consecință, la o încălcare a uniformității densității electronilor π în sistem.
Nomenclatură
Denumirea sistematică a tuturor hidrocarburilor aromatice este arene și benzen - benzen . Omologii benzenului sunt considerați benzen substituiți și numerele indică poziția substituenților. Cu toate acestea, nomenclatura sistematică permite denumirea de „benzen”, iar pentru unii omologi ai benzenului - denumiri banale: vinilbenzenul (I) se numește stiren, metilbenzen (II) - toluen, dimetilbenzen (III) - xilen, izopropilbenzen (IV) - cumene, metoxibenzen (V) - anisol etc.:
Radicalii aromatici au nume comun - Arils(Ar). Radical C 6 H 5 - numit fenil(de la numele vechi pentru benzen - „uscător de păr”).
Izomerie.
Formula generală a omologilor benzenului este C n H 2 n -6. Toți cei șase atomi de hidrogen dintr-o moleculă de benzen sunt identici, iar atunci când unul dintre ei este înlocuit cu același radical, se formează același compus. Prin urmare, benzenul monosubstituit nu are izomeri. De exemplu, există un singur metilbenzen:

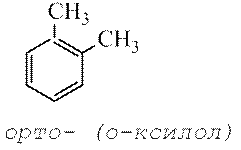
Când doi atomi de hidrogen sunt înlocuiți cu grupări metil, se formează trei izomeri - xilenele, care diferă între ele prin aranjarea substituenților în inel:



orto-dimetilbenzen, meta-dimetilbenzen, pereche-dimetilbenzen,
sau 1,2-dimetilbenzen sau 1,3-dimetilbenzen sau 1,4-dimetilbenzen
(O-xilen) ( m-xilen) ( n-xilen)
În loc de denumirea literei ( orto-, meta-, alin-, sau prescurtat: o-, m-, p-) puteți folosi digital: 1,2-, 1,3-, 1,4-. Izomerii pot diferi prin natura substituenților lor:


propilbenzen izopropilbenzen