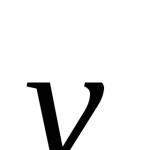Una dintre cele mai convingătoare dovezi ale realității mișcării moleculelor este fenomenul așa-numitei mișcări browniene, descoperit în 1827 de botanistul englez Brown când studia cei mai mici spori suspendați în apă. El a descoperit, atunci când a fost examinat la microscop la o mărire mare, că acești spori se aflau într-o mișcare constantă neregulată, ca și cum ar fi executat un dans fantastic sălbatic.
Experimente ulterioare au arătat că aceste mișcări nu sunt legate de originea biologică a particulelor sau de nicio mișcare a fluidelor. Mișcări similare sunt făcute de orice particule mici suspendate într-un lichid sau gaz. Astfel de mișcări neregulate sunt făcute, de exemplu, de particulele de fum din aerul nemișcat. Această mișcare aleatorie a particulelor suspendate într-un lichid sau gaz se numește mișcare browniană.
Studiile speciale au arătat că natura mișcării browniene depinde de proprietățile lichidului sau gazului în care particulele sunt suspendate, dar nu depinde de proprietățile substanței particulelor în sine. Viteza de mișcare a particulelor browniene crește odată cu creșterea temperaturii și odată cu scăderea dimensiunii particulelor.
Toate aceste regularități sunt ușor de explicat dacă acceptăm că mișcările particulelor în suspensie apar ca urmare a șocurilor pe care le experimentează de la moleculele în mișcare ale lichidului sau gazului în care se află.
Desigur, fiecare particulă browniană este supusă unor astfel de impacturi din toate părțile. Cu dezordinea completă a mișcărilor moleculare, s-ar părea că numărul de impacturi care cad asupra unei particule din orice direcție ar trebui să fie exact egal cu numărul de impacturi din direcția opusă,
astfel încât toate aceste șocuri trebuie să se anuleze complet și particulele trebuie să rămână nemișcate.
Este exact ceea ce se întâmplă dacă particulele nu sunt prea mici. Dar când avem de-a face cu particule microscopice, vezi), situația este diferită. Într-adevăr, din faptul că mișcările moleculare sunt haotice, rezultă doar că, în medie, numărul de impacturi în direcții diferite este același. Dar într-un astfel de sistem statistic precum un lichid sau un gaz, abaterile de la valorile medii sunt inevitabile. Astfel de abateri de la valorile medii ale anumitor cantități care apar într-un volum mic sau pe perioade scurte de timp se numesc fluctuații. Dacă un corp de dimensiuni obișnuite se află într-un lichid sau într-un gaz, atunci numărul de șocuri pe care le suferă din partea moleculelor este atât de mare încât nici șocurile individuale și nici predominanța aleatorie a șocurilor într-o direcție asupra șocurilor în alte direcții nu pot fi observat. Pentru particulele mici, numărul total de șocuri suferite de acestea este relativ mic, astfel încât predominanța numărului de impacturi dintr-o direcție sau alta devine remarcabilă și tocmai datorită unor astfel de fluctuații ale numărului de impacturi sunt caracteristice acelea. , parcă, apar mișcări convulsive ale particulelor suspendate, care se numesc mișcare browniană.
Este clar că mișcările particulelor browniene nu sunt mișcări moleculare: nu vedem rezultatul impactului unei molecule, ci rezultatul predominării numărului de impacturi într-o direcție asupra numărului de impacturi în direcția opusă. Mișcarea browniană dezvăluie doar foarte clar însăși existența mișcărilor moleculare dezordonate.
Astfel, mișcarea browniană se explică prin faptul că, datorită diferenței aleatoare a numărului de impacturi ale moleculelor asupra unei particule din direcții diferite, apare o anumită forță rezultantă a unei anumite direcții. Deoarece fluctuațiile sunt de obicei pe termen scurt, după o perioadă scurtă de timp direcția rezultantei se va schimba și, odată cu aceasta, se va schimba și direcția mișcării particulelor. De aici aleatorietatea observată a mișcărilor browniene, reflectând aleatorietatea mișcării moleculare.
Vom completa acum explicația calitativă de mai sus a mișcării browniene cu o considerație cantitativă a acestui fenomen. Teoria sa cantitativă a fost dată pentru prima dată de Einstein și, independent, de Smoluchowski (1905). Prezentăm aici o derivare mai simplă a relației principale a acestei teorii decât cele ale acestor autori.
Datorită compensării incomplete a impacturilor moleculare, după cum am văzut, o anumită forță rezultantă acționează asupra unei particule browniene, sub acțiunea căreia particula se mișcă. În plus față de această forță, particula este afectată de forța de frecare cauzată de vâscozitatea mediului și îndreptată împotriva forței
Pentru simplitate, presupunem că particula are forma unei sfere cu raza a. Atunci forța de frecare poate fi exprimată prin formula Stokes:
unde este coeficientul de frecare internă a lichidului (sau gazului), viteza particulei. Ecuația mișcării particulelor (a doua lege a lui Newton) are deci forma:
![]()
Aici este masa particulei, vectorul său de rază în raport cu un sistem de coordonate arbitrar, viteza particulei și rezultanta forțelor cauzate de impactul moleculelor.
Luați în considerare proiecția vectorului rază pe una dintre axele de coordonate, de exemplu, pe axă. Pentru această componentă, ecuația (7.1) va fi rescrisă sub forma:
unde este componenta forței rezultate de-a lungul axei
Sarcina noastră este să găsim deplasarea x a unei particule browniene, pe care o primește sub influența impacturilor moleculare. Fiecare dintre particule este supusă în mod constant la ciocniri cu molecule, după care își schimbă direcția mișcării. Diferitele particule primesc deplasări care diferă atât ca mărime, cât și ca direcție. Valoarea probabilă a sumei deplasărilor tuturor particulelor este egală cu zero, deoarece deplasările pot avea atât semne pozitive, cât și semne negative cu probabilitate egală. Valoarea medie a proiecției deplasării particulelor x va fi așadar zero. Cu toate acestea, valoarea medie a pătratului deplasării nu va fi egală cu zero, adică cantitatea x, deoarece nu își schimbă semnul atunci când semnul lui x se schimbă. Prin urmare, să transformăm ecuația (7.2) astfel încât să conțină mărimea Pentru a face acest lucru, înmulțim ambele părți ale acestei ecuații cu
Folosim identitățile evidente:
Înlocuind aceste expresii în (7.3), obținem:
Această egalitate este valabilă pentru orice particulă și, prin urmare, este valabilă și pentru valorile medii ale cantităților incluse în ea,
dacă media se realizează pe un număr suficient de mare de particule. Prin urmare, puteți scrie:
unde este valoarea medie a pătratului deplasării particulei, valoarea medie a pătratului vitezei sale. În ceea ce privește valoarea medie a cantității incluse în egalitate, aceasta este egală cu zero, deoarece pentru un număr mare de particule sunt luate la fel de des atât valorile pozitive, cât și cele negative. Prin urmare, ecuația (7.2) ia forma:
Valoarea din această ecuație este valoarea medie a pătratului proiecțiilor vitezei pe axă. Deoarece mișcările particulelor sunt complet haotice, valorile medii ale pătratelor proiecțiilor vitezei de-a lungul tuturor celor trei axe de coordonate trebuie să fie egale unul față de celălalt, adică

De asemenea, este evident că suma acestor cantități ar trebui să fie egală cu valoarea medie a pătratului vitezei particulelor.
![]()
Prin urmare,
![]()
Astfel, exprimarea interesului pentru noi, care este inclusă în (7.4), este egală cu:
![]()
Mărimea este energia cinetică medie a unei particule browniene. Ciocnind cu moleculele unui lichid sau gaz, particulele browniene schimbă energie cu ele și se află în echilibru termic cu mediul în care se mișcă. Prin urmare, energia cinetică medie a mișcării de translație a unei particule browniene trebuie să fie egală cu energia cinetică medie a moleculelor.
lichid (sau gaz), care, după cum știm, este
![]()
prin urmare
![]()
Faptul că energia cinetică medie a unei particule browniene este egală (ca și în cazul unei molecule de gaz!) Este de o importanță fundamentală. Într-adevăr, ecuația de bază (3.1) derivată mai devreme este valabilă pentru orice particule care nu interacționează între ele și efectuează mișcări haotice. Indiferent dacă vor fi molecule invizibile pentru ochi sau particule browniene mult mai mari, care conțin miliarde de molecule, nu are importanță. Din punct de vedere molecular-cinetic, o particulă browniană poate fi tratată ca o moleculă gigantică. Prin urmare, expresia energiei cinetice medii a unei astfel de particule trebuie să fie aceeași ca și pentru moleculă. Vitezele particulelor browniene, desigur, sunt incomparabil mai mici, corespunzătoare masei lor mai mari.
Să revenim acum la ecuația (7.4) și, ținând cont de (7.5), o rescriem
Această ecuație este ușor de integrat. Indicând obținem:
![]()
iar după separarea variabilelor, ecuația noastră se transformă în:

Integrând partea stângă a acestei ecuații în intervalul de la 0 la și partea dreaptă de la până la obținem:

![]()
Valoarea, după cum se poate observa cu ușurință, este neglijabilă în condiții experimentale normale. Într-adevăr, dimensiunea particulelor browniene nu depășește cm, vâscozitatea unui lichid este de obicei apropiată de vâscozitatea apei, adică aproximativ egală cu Prin urmare, dacă intervalul de timp dintre observațiile succesive ale unei particule browniene depășește ceea ce, desigur, întotdeauna are loc, atunci
![]()
Pentru intervale de timp finite și deplasări corespunzătoare, ecuația (7.6) poate fi rescrisă ca:
![]()
![]()
Valoarea medie a deplasării la pătrat a unei particule browniene pe un interval de timp de-a lungul axei X sau a oricărei alte axe este proporțională cu acest interval de timp.
Formula (7.7) face posibilă calcularea valorii medii a pătratului deplasărilor, iar media este preluată asupra tuturor particulelor care participă la fenomen. Dar această formulă este valabilă și pentru valoarea medie a pătratului multor deplasări succesive ale unei singure particule în intervale de timp egale.Din punct de vedere experimental, este mai convenabil să se observe deplasările unei singure particule. Astfel de observații au fost făcute de Perrin în 1909.
Perrin a observat mișcarea particulelor printr-un microscop, al cărui ocular era echipat cu o rețea de linii reciproc perpendiculare care servea ca sistem de coordonate. Folosind grila, Perrin a marcat pe ea pozițiile succesive ale unei particule pe care a ales-o la anumite intervale de timp (de exemplu, 30 s). Conectând apoi punctele care marchează poziția particulei pe grilă, a obținut o imagine similară cu cea din Fig. 7. Această figură prezintă atât deplasările particulei, cât și proiecțiile lor pe axă.
Trebuie avut în vedere că mișcarea unei particule este mult mai complicată decât se poate aprecia din fig. 7, deoarece pozițiile sunt marcate aici la intervale de timp nu prea scurte (de ordinul a 30 s). Dacă aceste goluri sunt reduse, atunci se dovedește că fiecare segment de linie dreaptă din figură se desfășoară în aceeași traiectorie complexă în zig-zag ca întreaga figură. 7.
Deoarece constanta poate fi determinată din ecuația de stare.
Experimentele lui Perrin au avut mare importanță pentru fundamentarea finală a teoriei molecular-cinetice.
Mișcarea browniană
Din Mișcarea browniană (Enciclopedia Elemente)
În a doua jumătate a secolului al XX-lea, o discuție serioasă despre natura atomilor a izbucnit în cercurile științifice. Pe de o parte erau autorități de necontestat precum Ernst Mach (cm. Unde de șoc), care a susținut că atomii sunt pur și simplu funcții matematice care descriu cu succes fenomene fizice observabile și nu au o bază fizică reală. Pe de altă parte, oamenii de știință ai noului val - în special, Ludwig Boltzmann ( cm. constanta Boltzmann) - a insistat că atomii sunt realități fizice. Și nici una dintre cele două părți nu știa că deja cu decenii înainte de începerea disputei lor s-au obținut rezultate experimentale care au decis odată pentru totdeauna chestiunea în favoarea existenței atomilor ca realitate fizică - totuși, acestea au fost obținute în disciplina de științe naturale adiacentă fizicii de către botanistul Robert Brown.
În vara anului 1827, Brown, în timp ce studia comportamentul polenului la microscop (a studiat o suspensie apoasă de polen de plante Clarkia pulchella), a descoperit brusc că sporii individuali fac mișcări impulsive absolut haotice. El a stabilit cu certitudine că aceste mișcări nu erau în niciun fel legate nici de turbioarele și curenții de apă, nici de evaporarea acesteia, după care, după ce a descris natura mișcării particulelor, și-a semnat sincer propria neputință de a explica originea această mișcare haotică. Cu toate acestea, fiind un experimentator meticulos, Brown a descoperit că o astfel de mișcare haotică este caracteristică oricăror particule microscopice, fie că este vorba de polen de plante, suspensii minerale sau orice substanță zdrobită în general.
Abia în 1905, nimeni altul decât Albert Einstein, a realizat pentru prima dată că acest fenomen misterios, la prima vedere, servește drept cea mai bună confirmare experimentală a corectitudinii teoriei atomice a structurii materiei. El a explicat cam așa: un spor suspendat în apă este supus unui „bombardament” constant prin mișcarea aleatorie a moleculelor de apă. În medie, moleculele acționează asupra ei din toate părțile cu intensitate egală și la intervale regulate. Totuși, oricât de mică ar fi disputa, din cauza abaterilor pur aleatorii, ea primește mai întâi un impuls din partea moleculei care a lovit-o dintr-o parte, apoi din partea moleculei care a lovit-o din cealaltă și așadar ca rezultat al medierii unor astfel de ciocniri, se dovedește că, la un moment dat, particula „se zvâcnește” într-o direcție, atunci, dacă pe cealaltă parte a fost „împinsă” de mai multe molecule - în cealaltă, etc. legile statisticii matematice și teoria molecular-cinetică a gazelor, Einstein a derivat ecuația, descriind dependența deplasării rms a unei particule browniene de parametrii macroscopici. ( Fapt interesant: într-unul din volumele revistei germane „Annals of Physics” ( Annalen der Physik) în 1905, au fost publicate trei articole de Einstein: un articol cu o explicație teoretică a mișcării browniene, un articol despre fundamentele teoriei speciale a relativității și, în final, un articol care descrie teoria efectului fotoelectric. Pentru acesta din urmă a fost premiat Albert Einstein Premiul Nobel la fizică în 1921.)
În 1908, fizicianul francez Jean-Baptiste Perrin (Jean-Baptiste Perrin, 1870-1942) a condus o serie strălucită de experimente care au confirmat corectitudinea explicației lui Einstein asupra fenomenului mișcării browniene. În sfârșit, a devenit clar că mișcarea „haotică” observată a particulelor browniene este o consecință a coliziunilor intermoleculare. Deoarece „convențiile matematice utile” (conform lui Mach) nu pot conduce la mișcări observabile și complet reale ale particulelor fizice, a devenit în sfârșit clar că dezbaterea despre realitatea atomilor s-a încheiat: ei există în natură. Ca „joc bonus”, Perrin a primit formula derivată de Einstein, care i-a permis francezului să analizeze și să estimeze numărul mediu de atomi și/sau molecule care se ciocnesc cu o particulă suspendată într-un lichid într-o anumită perioadă de timp și, folosind aceasta indicator, calculați numerele molare ale diferitelor lichide. Această idee se baza pe faptul că fiecare acest moment timp, accelerația unei particule în suspensie depinde de numărul de ciocniri cu moleculele mediului ( cm. legile mecanicii lui Newton) și, prin urmare, asupra numărului de molecule pe unitatea de volum de lichid. Și asta nu este altceva decât numărul lui Avogadro (cm. Legea lui Avogadro) este una dintre constantele fundamentale care determină structura lumii noastre.
Din Mișcarea browniană În orice mediu există fluctuații constante de presiune microscopică. Aceștia, acționând asupra particulelor plasate în mediu, duc la deplasările lor aleatorii. Această mișcare haotică a celor mai mici particule dintr-un lichid sau gaz se numește mișcare browniană, iar particula însăși se numește brownian.Mișcarea browniană Mișcarea browniană
(Mișcarea browniană), mișcarea aleatorie a particulelor mici suspendate într-un lichid sau gaz, sub influența impactului molecular mediu inconjurator; descoperit de R. Brown.
MIȘCARE BROWNIANĂBROWNIAN MOVEMENT (Brownian motion), mișcarea aleatorie a celor mai mici particule suspendate într-un lichid sau gaz, care are loc sub influența impactului moleculelor de mediu; descoperit de R. Brown (cm. BROWN Robert (botanist)în 1827
Când a observat o suspensie de polen de flori în apă la microscop, Brown a observat o mișcare haotică a particulelor care apare „nu din mișcarea lichidului și nu din evaporarea acestuia”. Particulele suspendate de 1 µm sau mai puțin, vizibile numai la microscop, au efectuat mișcări independente dezordonate, descriind traiectorii complexe în zig-zag. Mișcarea browniană nu slăbește în timp și nu depinde de proprietățile chimice ale mediului, intensitatea acesteia crește odată cu creșterea temperaturii mediului și cu scăderea vâscozității și a dimensiunii particulelor. Chiar și o explicație calitativă a cauzelor mișcării browniene a fost posibilă doar 50 de ani mai târziu, când cauza mișcării browniene a început să fie asociată cu impactul moleculelor lichide pe suprafața unei particule suspendate în ea.
Prima teorie cantitativă a mișcării browniene a fost dată de A. Einstein (cm. EINSTEIN Albert)şi M. Smoluchovsky (cm. SMOLUHHOVSKY Marian)în 1905-06 bazat pe teoria cinetică moleculară. S-a demonstrat că mersurile aleatorii ale particulelor browniene sunt asociate cu participarea lor la mișcarea termică împreună cu moleculele mediului în care sunt suspendate. Particulele au în medie la fel energie kinetică, dar datorită masei mai mari au o viteză mai mică. Teoria mișcării browniene explică mișcarea aleatoare a unei particule prin acțiunea forțelor aleatorii din molecule și a forțelor de frecare. Conform acestei teorii, moleculele unui lichid sau gaz sunt în mișcare termică constantă, iar impulsurile diferitelor molecule nu sunt aceleași ca mărime și direcție. Dacă suprafața unei particule plasate într-un astfel de mediu este mică, așa cum este cazul unei particule browniene, atunci impacturile experimentate de particule din moleculele din jur nu vor fi compensate exact. Prin urmare, ca urmare a „bombardamentului” de către molecule, o particulă browniană începe să se miște aleatoriu, schimbând magnitudinea și direcția vitezei sale de aproximativ 10 14 ori pe secundă. Din această teorie a rezultat că, măsurând deplasarea unei particule într-un anumit timp și cunoscând raza acesteia și vâscozitatea lichidului, se poate calcula numărul Avogadro. (cm. AVOGADRO CONSTANT).
Concluziile teoriei mișcării browniene au fost confirmate de măsurătorile lui J. Perrin (cm. PERRIN Jean Baptiste)şi T. Svedberg (cm. SWEDBERG Theodor)în 1906. Pe baza acestor relaţii s-a determinat experimental constanta Boltzmann (cm. BOLTZMANN CONSTANT)și constanta Avogadro.
Când se observă mișcarea browniană, poziția unei particule este fixată la intervale regulate. Cu cât intervalele de timp sunt mai scurte, cu atât mai întreruptă va arăta traiectoria particulei.
Modelele mișcării browniene servesc ca o confirmare clară a prevederilor fundamentale ale teoriei cinetice moleculare. S-a stabilit în cele din urmă că forma termică a mișcării materiei se datorează mișcării haotice a atomilor sau moleculelor care alcătuiesc corpurile macroscopice.
A jucat teoria mișcării browniene rol importantîn fundamentarea mecanicii statistice se bazează pe teoria cinetică a coagulării soluţiilor apoase. În plus, are și ea valoare practicăîn metrologie, deoarece mișcarea browniană este considerată principalul factor care limitează acuratețea instrumentelor de măsură. De exemplu, limita de precizie a citirilor unui galvanometru oglindă este determinată de tremurul oglinzii, ca o particulă brownian bombardată de molecule de aer. Legile mișcării browniene determină mișcarea aleatorie a electronilor, provocând zgomot în interior circuite electrice. Pierderile dielectrice în dielectrici sunt explicate prin mișcări aleatorii ale moleculelor dipolului care alcătuiesc dielectricul. Mișcările aleatorii ale ionilor în soluțiile de electroliți măresc rezistența electrică a acestora.
Dicţionar enciclopedic. 2009 .
Vedeți ce este „mișcarea browniană” în alte dicționare:
- (Mișcarea browniană), mișcarea aleatorie a particulelor mici suspendate într-un lichid sau gaz, care se produce sub influența impactului moleculelor de mediu. Investigat în 1827 de către englezi. om de știință R. Brown (Brown; R. Brown), care a observat printr-un microscop ... ... Enciclopedia fizică
MIȘCARE BROWNIANĂ- (Maro), mișcarea celor mai mici particule suspendate într-un lichid, care are loc sub influența ciocnirilor dintre aceste particule și moleculele lichidului. A fost văzut pentru prima dată la microscop. botanist Brown în 1827. Dacă la vedere ...... Marea Enciclopedie Medicală
- (mișcarea browniană) mișcarea aleatorie a celor mai mici particule suspendate într-un lichid sau gaz, sub influența impactului moleculelor de mediu; descoperit de R. Brown... Dicţionar enciclopedic mare
MIȘCARE BROWNIAN, mișcare dezordonată, în zig-zag a particulelor suspendate într-un curent (lichid sau gaz). Este cauzată de bombardarea neuniformă a particulelor mai mari din diferite părți de către molecule mai mici ale unui flux în mișcare. Aceasta… … Dicționar enciclopedic științific și tehnic
Mișcarea browniană- - oscilatoare, rotative sau mișcare înainte particulele fazei dispersate sub acţiunea mişcării termice a moleculelor mediului de dispersie. Chimie generală: manual / A. V. Zholnin ... Termeni chimici
MIȘCARE BROWNIANĂ- mișcarea aleatorie a celor mai mici particule suspendate într-un lichid sau gaz, sub influența impactului moleculelor de mediu aflate în mișcare termică; joacă un rol important în unele fizice. chimic. procese, limitează acuratețea... Marea Enciclopedie Politehnică
Mișcarea browniană- — [Ya.N. Luginsky, M.S. Fezi Zhilinskaya, Yu.S. Kabirov. Dicționar englez rus de inginerie electrică și industria energetică, Moscova, 1999] Subiecte în inginerie electrică, concepte de bază ale mișcării browniene EN ... Manualul Traducătorului Tehnic
Acest articol sau secțiune necesită revizuire. Vă rugăm să îmbunătățiți articolul în conformitate cu regulile de scriere a articolelor... Wikipedia
Mișcarea haotică continuă a particulelor microscopice suspendate într-un gaz sau lichid, datorită mișcării termice a moleculelor mediului. Acest fenomen a fost descris pentru prima dată în 1827 de botanistul scoțian R. Brown, care a studiat sub ... ... Enciclopedia Collier
Mișcarea browniană este o mișcare mai corectă, aleatorie, a particulelor mici (de câțiva microni sau mai puțin de dimensiuni) suspendate într-un lichid sau gaz, care au loc sub acțiunea șocurilor de la moleculele mediului. Descoperit de R. Brown în 1827. ...... Marea Enciclopedie Sovietică
Cărți
- Mișcarea browniană a unui vibrator, Yu.A. Krutkov, reprodus în ortografia originală a autorului ediției din 1935 (editura `Proceedings of the Academy of Sciences of the URSS`). LA… Categorie: Matematică Editor:
Mișcarea browniană- mișcarea haotică a particulelor microscopice de materie solidă vizibilă suspendată într-un lichid sau gaz, cauzată de mișcarea termică a particulelor dintr-un lichid sau gaz. Mișcarea browniană nu se oprește niciodată. Mișcarea browniană este legată de mișcarea termică, dar aceste concepte nu trebuie confundate. Mișcarea browniană este o consecință și o dovadă a existenței mișcării termice.
Mișcarea browniană este cea mai evidentă confirmare experimentală a ideilor teoriei cinetice moleculare despre mișcarea termică haotică a atomilor și moleculelor. Dacă intervalul de observație este suficient de mare încât forțele care acționează asupra particulei din moleculele mediului își schimbă direcția de multe ori, atunci pătratul mediu al proiecției deplasării acesteia pe orice axă (în absența altor forțe externe) este proporțional cu timpul.
Când se derivă legea lui Einstein, se presupune că deplasările particulelor în orice direcție sunt la fel de probabile și că inerția unei particule browniene poate fi neglijată în comparație cu influența forțelor de frecare (acest lucru este acceptabil pentru perioade suficient de lungi). Formula pentru coeficient D se bazează pe aplicarea legii lui Stokes pentru rezistența hidrodinamică la mișcarea unei sfere cu raza A într-un fluid vâscos. Rapoartele pentru A și D au fost confirmate experimental prin măsurătorile lui J. Perrin și T. Svedberg. Din aceste măsurători, constanta Boltzmann este determinată experimental kși constanta Avogadro N A. Pe lângă mișcarea browniană de translație, există și o mișcare browniană de rotație - rotație aleatorie a unei particule browniene sub influența impactului moleculelor mediului. Pentru mișcarea browniană de rotație, deplasarea unghiulară rms a unei particule este proporțională cu timpul de observare. Aceste relații au fost confirmate și de experimentele lui Perrin, deși acest efect este mult mai greu de observat decât mișcarea browniană de translație.
YouTube enciclopedic
-
1 / 5
Mișcarea browniană are loc datorită faptului că toate lichidele și gazele constau din atomi sau molecule - cele mai mici particule care se află în mișcare termică haotică constantă și, prin urmare, împing continuu particula browniană din diferite părți. S-a descoperit că particulele mari mai mari de 5 µm practic nu participă la mișcarea browniană (sunt imobile sau sedimente), particulele mai mici (mai puțin de 3 µm) se deplasează înainte de-a lungul traiectoriilor foarte complexe sau se rotesc. Când un corp mare este scufundat în mediu, atunci șocurile care apar în număr mare sunt mediate și formează o presiune constantă. Dacă un corp mare este înconjurat de un mediu din toate părțile, atunci presiunea este practic echilibrată, rămâne doar forța de ridicare a lui Arhimede - un astfel de corp plutește fără probleme sau se scufundă. Dacă corpul este mic, ca o particulă browniană, atunci fluctuațiile de presiune devin vizibile, ceea ce creează o forță vizibilă care se schimbă aleatoriu, ducând la oscilații ale particulei. Particulele browniene de obicei nu se scufundă sau plutesc, ci sunt suspendate într-un mediu.
Deschidere
Teoria mișcării browniene
Construirea teoriei clasice
D = R T 6 N A π a ξ , (\displaystyle D=(\frac (RT)(6N_(A)\pi a\xi)),)
Unde D (\displaystyle D)- coeficientul de difuzie, R (\displaystyle R)- constanta gas universală, T (\displaystyle T)- temperatura absolută, N A (\displaystyle N_(A)) este constanta Avogadro, a (\displaystyle a)- raza particulelor, ξ (\displaystyle \xi )- vascozitate dinamica.
Confirmare experimentală
Formula lui Einstein a fost confirmată de experimentele lui Jean Perrin și studenții săi din 1908-1909. Ca particule browniene, au folosit boabele de rășină ale arborelui de mastic și gummigut, sucul gros de lapte al copacilor din genul Garcinia. Valabilitatea formulei a fost stabilită pentru diferite dimensiuni ale particulelor - de la 0,212 microni până la 5,5 microni, pentru diverse soluții (soluție de zahăr, glicerină) în care particulele s-au deplasat.
Mișcarea browniană ca proces aleator non-Markovian
Teoria mișcării browniene, bine dezvoltată în ultimul secol, este aproximativă. Și deși în majoritatea cazurilor de importanță practică teoria existentă dă rezultate satisfăcătoare, în unele cazuri poate necesita clarificări. Astfel, munca experimentală desfășurată la începutul secolului XXI în Universitatea Politehnică Lausanne, Universitatea din Texas și Laboratorul European de Biologie Moleculară din Heidelberg (sub conducerea lui S. Janey) au arătat diferența în comportamentul unei particule browniene față de cel prezis teoretic de teoria Einstein-Smoluchowski, care a fost deosebit de vizibilă odată cu creșterea dimensiunile particulelor. Studiile s-au referit, de asemenea, la analiza mișcării particulelor înconjurătoare ale mediului și au arătat o influență reciprocă semnificativă a mișcării particulei browniene și a mișcării particulelor mediului cauzate de aceasta una asupra altora, adică prezența unei „memorii” în particula browniană, sau, cu alte cuvinte, dependența caracteristicilor sale statistice în viitor de întreaga preistorie comportamentul ei în trecut. Acest lucru nu a fost luată în considerare în teoria Einstein-Smoluchowski.
Procesul de mișcare browniană a unei particule într-un mediu vâscos, în general, aparține clasei de procese non-Markovie, iar pentru descrierea sa mai precisă este necesar să se utilizeze ecuații stocastice integrale.
mișcarea termică
Orice substanță constă din cele mai mici particule - molecule. Moleculă este cea mai mică particulă dintr-o substanță dată care își păstrează tot Proprietăți chimice. Moleculele sunt situate discret în spațiu, adică la anumite distanțe unele de altele și se află într-o stare continuă. mișcare neregulată (haotică). .
Deoarece corpurile constau dintr-un număr mare de molecule și mișcarea moleculelor este aleatorie, este imposibil să spunem cu exactitate câte impacturi vor experimenta această sau acea moleculă de la alții. Prin urmare, ei spun că poziția moleculei, viteza acesteia în fiecare moment de timp este aleatorie. Totuși, acest lucru nu înseamnă că mișcarea moleculelor nu respectă anumite legi. În special, deși vitezele moleculelor la un moment dat în timp sunt diferite, cele mai multe dintre ele au viteze apropiate de o anumită valoare definită. De obicei, când se vorbește despre viteza de mișcare a moleculelor, ele înseamnă viteza medie (v$cp).
Este imposibil de identificat vreo direcție anume în care se mișcă toate moleculele. Mișcarea moleculelor nu se oprește niciodată. Putem spune că este continuă. O astfel de mișcare haotică continuă a atomilor și moleculelor se numește -. Acest nume este determinat de faptul că viteza de mișcare a moleculelor depinde de temperatura corpului. Cu cât viteza medie de mișcare a moleculelor corpului este mai mare, cu atât temperatura acestuia este mai mare. În schimb, cu cât temperatura corpului este mai mare, cu atât viteza medie a moleculelor este mai mare.

Mișcarea moleculelor lichide a fost descoperită prin observarea mișcării browniene - mișcarea particulelor solide foarte mici suspendate în ea. Fiecare particulă face continuu salturi în direcții arbitrare, descriind traiectoria sub forma unei linii întrerupte. Acest comportament al particulelor poate fi explicat presupunând că acestea suferă impacturi ale moleculelor lichide simultan din diferite părți. Diferența în numărul acestor impacturi din direcții opuse duce la mișcarea particulei, deoarece masa acesteia este proporțională cu masele moleculelor înseși. Mișcarea unor astfel de particule a fost descoperită pentru prima dată în 1827 de botanistul englez Brown, observând particulele de polen din apă la microscop, motiv pentru care a fost numită - Mișcarea browniană.