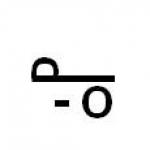Lucrări independente de chimie organică pe teme:
„Alcani”, „Alchene”, „Alchine”.
Profesor de chimie Zhuravleva T.K.
Lucrare independentă pe tema: Alcani
Opțiunea 1
1. Meci:
Concept:
1) omologi, 2) izomeri.
Definiție:
a) substanțe similare ca structură și proprietăți, a căror compoziție diferă prin una sau mai multe grupe CH2.
b) substanţe care au aceeaşi compoziţie, dar structuri chimice diferite.
2. Formula generală a alcanilor
a) CnH2n-6, b) CnH2n-2, c) CnH2n, d) CnH2n+2.
3.
a) C2H8, b) C2H6, c) C5H8, d) C6H6.
Denumiți această substanță și scrieți formula structurală completă.
4. Găsiți formula izomerului pentanului:
a) CH3-CH-CH3, b) CH3-CH2, c) CH2-CH2 d) CH3-CH2
│ │ │ │ │
CH3CH3CH3CH3CH-CH3
5. Omologuri sunt substanțe:
a) C3H8 și C2H2, b) C5H12 și C3H6, c) C2H2 și C6H6, d) CH4 și C2H6
6. Alcanii se caracterizează prin următoarele reacții:
a) adiţie b) substituţie c) polimerizare.
7. Meci:
Formula alcanilor :
1) CH3-CH2-CH2-CH22) CH3-CH2-CH2-CH2
CH 3 CH 3 CH 2 - CH 3
Nume:
a) 2-metilpentan, b) hexan
Opțiunea nr. 2
1. Completați cuvântul care lipsește:
a) Substanțele care sunt similare ca structură și proprietăți, dar a căror compoziție diferă prin una sau mai multe grupe CH 2, se numesc -___. b) Substanțele care au aceeași compoziție elementară, dar structuri chimice diferite se numesc _________.
2. Hidrocarburile saturate au formula generală:
a) C n H 2 n -6, b) C n H 2 n -2, c) C n H 2 n, d) C n H 2 n +2
3. Specificați formula hidrocarburii saturate:
a) C2H4, b) C3H4, c) C4H10, d) C6H6.
4. Găsiți formula pentru omologul butanului:
a) CH3-CH2, b) CH3-CH2-CH-CH3, c) CH3-CH2-CH2-CH3
CH2-CH2-CH3CH3
d) CH3-CH-CH3
5. Omologuri sunt substanțe cu structură normală:
a) CH4 și C2H4, b) C3H8 și C5H12, c) C4H8 și C8H18, d) CH4 și C6H10
6. Alcătuiți formulele izomerului și omologului hexanului
7. Potrivire:
Formula alcanului: 1) CH3-CH2-CH-CH2CH2-CH32) CH3-CH2-CH-CH-CH3
C2H5CH3CH3
Nume:
a) 3-etilhexan, b) 2,3-dimetilpentan
Lucrare independentă pe tema: Alchenes.
Opțiunea 1
a) omolog; b) izomer;
CH 2 = CH – CH – CH 2 – CH 2 - CH 3
CH 3
CH 3 |
a) CH 3 – CH = C – CH – CH 3 b) CH 2 = C – CH 2 – CH – CH 3
׀ ׀ ׀
CH 3 CH 3 CH 2 – CH 3
3.Obținerea unei alchene prin dehidrogenarea butanului.
4.Scrieți ecuațiile reacțiilor chimice și indicați tipul reacțiilor:
a) CH 2 = CH – CH 3 + H 2 →
b) CH 3 - CH =CH – CH 3 + Br 2 →
c) C2H4 + O2 →
d) CH2 = CH -CH2 + HCI →
Opțiunea nr. 2
1. Alcătuiți formule structurale:
a) omolog; b) izomer;
c) izomer al poziţiei dublei legături.
pentru o substanta avand structura
CH 3 – CH = CH – CH – CH 3
C2H5
2. Denumiți următoarele hidrocarburi folosind nomenclatura sistematică:
CH 3
a) CH 2 = C – CH 2 – CH 2 b) CH 3 – CH= C – C – CH 3
׀ ׀ ׀
CH 3 CH 3 CH 3
3.Obține propenă prin deshidratarea alcoolului.
4.Scrieți ecuațiile reacțiilor chimice și indicați tipul de reacție:
a) CH 2 = CH – CH 2 – CH 3 + H 2 O →
b) CH2 = CH2 + H2 →
c) CH2 = CH2 + HCL →
d) C3H6 + O2 →
Muncă independentă
Probleme cu alchene
Proprietățile chimice sunt destul de diferite de proprietățile dublei legături care provoacă reacții de adiție; în general, alchenele sunt compuși mai reactivi. Formula generală a compușilor este СnH2n.
In acest problema cu alchene se da o reactie de oxidare. Într-o soluție de permanganat de potasiu, KMnO4 este oxidat în dioli - alcooli dihidroxilici, iar permanganatul este redus la oxid de mangan (IV). Reacția va arăta astfel:
3|СnH2n + 2OH(-) -2e → CnH2n(OH)2
2 |MnO4(-) +2H2O +3e → MnO2 + 4OH(-)
3CnH2n +6OH(-) +2MnO4(-) + 4H2O → 3CnH2n(OH)2 + 2MnO2 + 8OH(-).
Ecuația finală:
ZS n H 2 n + 2KMnO 4 + 4H 2 O → 3C n H 2 n (OH) 2 + 2MnO 2 ↓ + 2KOH
Precipitatul format este oxid de mangan (IV) - MnO2.Să notăm masa alchenei cu X. Atunci masa MnO2 va fi egală cu 2,07X
Conform reacției, alchena și oxidul de mangan reacţionează 3:2.
Aceasta înseamnă că raportul dintre moli de substanțe poate fi scris după cum urmează:
X\ 3·(12n +2n) = 2,07x\87·2
unde 12n+2n este masa molară și 87 g\mol este masa molară a MnO2
n= 2
Acestea. alchenă, care a fost supus oxidării - etilenă - C2H4.
Problema cu alchenele nr. 2

Proprietățile chimice sunt determinate de capacitatea lor de a atașa substanțele; o legătură dublă se transformă într-o legătură simplă:
СnH2n + Cl2 → CnH2nCl2
CnH2n + Br2 → CnH2nBr2
m(CnH2nCl2) = 56,5 g\mol
m(CnH2nBr2) = 101 g\mol
Masa alchenei care a intrat în reacție este aceeași, ceea ce înseamnă același număr de moli.
Prin urmare, exprimăm numărul de moli de hidrocarbură - n(CnH2n):
m(CnH2nCl2) \ (12n+2n+71) = m(nH2nBr2) \ (12n+2n+160)
12n+2n+71 este masa molară a derivatului dicloro,
(12n+2n+160) este masa molară a derivatului dibromo.
56,5 \ (12n+2n+71) = 101 \ (12n+2n+160)
n= 3, alchenă - C3H6
În schimb, ele suferă în principal reacții de adiție. ÎN probleme cu alchene toate reacțiile sunt simple și de obicei se rezumă la determinarea formulei substanței.
Problema cu alchenele nr. 3
Ecuația reacției:
Alchenele reacţionează doar cu un catalizator, deci va exista o singură reacţie în această problemă.
m(Br2) = m(soluție) ω = 100 g 0,181 = 18,1 g
Să notăm masa de brom care a reacționat ca x
Bromul în soluție va fi determinat de masa de brom nereacționat
m(Br2) = 18,1 - x.
Masa soluției = 100 + m(C3H6).
Hidrocarburi nesaturate.
Alchenele
CLASA 10
Această lecție este o lecție de învățare a materialelor noi sub forma unei prelegeri cu elemente de conversație și munca independentă a studenților.
Elevii lucrează în trei grupe. În fiecare grupă există un profesor asistent care distribuie munca fiecărui elev din această grupă. Fiecare elev are un memento.
ADUCERE AMINTE
Rezultatele învățării planificateȘtii: determinarea hidrocarburilor nesaturate din seria etilenei, formula generală a alchenelor, patru tipuri de izomerie ale alchenelor, proprietățile lor fizice și chimice, metodele de producție și domeniile de aplicare a hidrocarburilor din seria etilenei.
A fi capabil să: explicați caracteristicile formării legăturilor - și -, notați formulele moleculare, structurale și electronice ale alchenelor, desemnați distribuția densității electronilor în moleculă, denumiți substanțele din seria etilenei conform nomenclaturii sistematice și scrieți formulele acestora folosind denumirile substanțelor, creați formule pentru diferiți izomeri folosind formula moleculară a alchenei, scrieți ecuații reacții care caracterizează proprietățile chimice ale alchenelor, comparați proprietățile alchenelor cu proprietățile hidrocarburilor saturate, rezolvați problemele de găsire a formulei moleculare .
Goluri. Educational: să învețe să deducă formula generală a alchenelor, să cunoască proprietățile lor fizice și chimice, să fie capabil să noteze formulele moleculare și structurale ale alchenelor, să denumească substanțele conform nomenclaturii sistematice, să dezvolte abilități în rezolvarea problemelor pentru a găsi formula moleculară.
Educational: cultivați dorința de a învăța activ, cu interes, insuflați disciplină conștientă, claritate și organizare în muncă, lucrați sub deviza: „Unul pentru toți și toți pentru unul”.
Metode și tehnici de lecție
- Lucru individual cu carduri.
- Lucrați în grupuri și perechi.
- Experiment chimic demonstrativ.
- Utilizarea mijloacelor tehnice de predare.
- Lucrări independente privind elaborarea formulelor de substanțe.
- Răspunsuri orale la tablă.
- Luarea notițelor din manual într-un caiet.
Planul subiectului lecției
(scrise pe tablă)
1. Structura moleculei de etilenă C 2 H 4.
2. Izomeria și nomenclatura alchenelor.
3. Prepararea alchenelor.
4. Proprietăți fizice.
5. Proprietăți chimice.
6. Aplicare.
7. Legătura genetică.
Echipamente și reactivi. Carduri cu sarcini, un proiector grafic și diapozitive, un trepied, un dispozitiv pentru obținerea și colectarea gazelor, o lampă cu alcool, eprubete, nisip, o lingură chimică; alcool etilic, permanganat de potasiu, apă cu brom, acid sulfuric (conc.).
ÎN CURILE CURĂRILOR
Lecția începe cu o conversație sub formă sondaj frontal. Scopul acestei părți a lecției este de a crea o „situație de succes”. Elevii înțeleg întrebările, cunosc răspunsurile la acestea și sunt implicați activ în muncă.
1. Care este lungimea legăturii?
(Lungimea legăturii este distanța dintre centre
nuclee de atomi legați într-o moleculă.)
2. Ce se poate spune despre lungimea legăturii carbon-carbon a substanțelor cu o legătură simplă (C-C) și dublă (C=C)?
(Lungimea legăturii simple carbon-carbon – 0,154 nm
legătură dublă - 0,133 nm, legătura dublă este mai puternică și mai scurtă decât legătura simplă.)
3. Câte legături pot apărea între atomi?
4. Ce se poate spune despre puterea legăturii?
(Este mai puțin durabil decât un singur - conexiune.)
5. Ce legătură chimică se formează între norii hibridizați?
6. Câți electroni de valență are un atom de carbon?
Muncă independentă.
Derivarea formulei moleculare
Sarcină. În compus, fracția de masă a carbonului este de 85,7%, fracția de masă a hidrogenului este de 14,3%, densitatea hidrogenului este de 14. Deduceți formula moleculară a hidrocarburii.
(Unul dintre elevi decide la consiliu.)
Dat:
(C) = 85,7% (sau 0,857),
(H) = 14,3% (sau 0,143),
D(H2) = 14.
Găsi:
C X H y .
Soluţie
M(C X H y) = 14 2 = 28 g/mol.
Pentru 1 mol C X H y m(C X H y) = 28 g,
m(C) = 28 (g) 0,857 = 24 g,
n(C) = 24 (g)/12 (g/mol) = 2 mol,
m(H) = 28 (g) 0,143 = 4 g,
n(H) = 4 (g)/1 (g/mol) = 4 mol.
Formula hidrocarburii este C2H4.
Concluzionăm că molecula de C 2 H 4 nu este saturată cu atomi de hidrogen.
Structura moleculei de etilenă C 2 H 4
Demonstrăm un model al unei molecule de hidrocarburi date printr-un proiector grafic.
Molecula C 2 H 4 este plată, atomii de carbon care formează legătura dublă sunt în stare
sp 2-hibridare, unghi de legătură 120°.
Compunem o serie omologică: C 2 H 4, C 3 H 6, C 4 H 8 ... și derivăm formula generală C n H 2 n .
Să rezumam etapa pe care am trecut-o.
Izomeria și nomenclatura alchenelor
Tipuri de izomerie
1) Luați în considerare formulele structurale ale alchenelor liniare și ramificate având aceeași formulă moleculară C 4 H 8:

Acest tip de izomerie se numește izomeria scheletului de carbon.
2) Izomeria poziției legăturilor multiple:
3) Izomeria diferitelor serii omoloage. Formula generala C n H 2 n corespunde două serii omoloage: alchene și cicloparafine. De exemplu, formula C4H8 poate aparține compușilor din diferite clase:

4) Izomerie spațială sau geometrică. În buten-2 CH 3 – CH = CH – CH 3, fiecare carbon de la legătura dublă are substituenți diferiți (H și CH 3). În astfel de cazuri, izomeria cistrans este posibilă pentru alchene. Dacă elementele lanțului de carbon principal se află pe o parte a legăturii duble în planul moleculei, atunci aceasta este cizizomer; dacă pe părți opuse, atunci asta izomer trans:

Muncă independentă folosind carduri (5 min)
Numiți substanțele.
grupa 1:

a 2-a grupa:

a 3-a grupa:

Lucrarea independentă finalizată este înregistrată pe film și proiectată printr-un proiector grafic pe ecran. Elevii își exercită autocontrolul.
Prepararea alchenelor
1) Deshidratarea alcoolilor (experienta demonstrativa de producere a etilenei din alcool etilic):
![]()
2) Dehidrogenarea alcanilor:

3) Piroliza și cracarea petrolului și a gazelor naturale:
4) Din alcani halogenați:

Proprietăți fizice
Alchene - etenă, propenă și butenă - în condiții normale (20 ° C, 1 atm) - gaze, de la C 5 H 10 la C 18 H 36 - lichide, alchene superioare - solide. Alchenele sunt insolubile în apă, dar solubile în solvenți organici.
Proprietăți chimice
În chimia organică sunt considerate trei tipuri de reacții chimice: substituție, adiție și descompunere.
1) Alchenele se caracterizează prin reacții de adiție.
Adăugarea de hidrogen (hidrogenare):
![]()
Adăugarea de halogeni (experiment de laborator privind decolorarea apei cu brom):
![]()
Adăugarea de halogenuri de hidrogen:
![]()
Regula lui Markovnikov: hidrogenul se atașează la locul unei legături multiple la un carbon mai hidrogenat, iar un halogen la unul mai puțin hidrogenat.
De exemplu:
Reacția are loc printr-un mecanism ionic.
Adăugarea de apă (reacție de hidratare):
![]()
2) Reacții de oxidare.

Experiență demonstrativă. Ethene decolorează o soluție de permanganat de potasiu, ceea ce demonstrează natura nesaturată a etenei:
Etilenglicolul este folosit ca antigel; este folosit pentru a produce fibre de lavsan și explozivi.
Oxidarea etenei pe un catalizator de argint produce oxid de etilenă:

Oxidul de etilenă este folosit pentru a produce acetaldehidă, detergenți, lacuri, materiale plastice, cauciucuri și fibre și produse cosmetice.
3) Reacția de polimerizare.
Procesul de combinare a multor molecule identice în altele mai mari se numește reacție de polimerizare.
 Determinați formula moleculară a unei hidrocarburi care conține 85,7% carbon și are o densitate a hidrogenului de 21.
Determinați formula moleculară a unei hidrocarburi care conține 85,7% carbon și are o densitate a hidrogenului de 21.
Dat:
(C) = 0,857 (sau 85,7%),
D(H2) = 21.
Găsi:
Soluţie
M(C X H y) = D(H2) M(H2) = 212 = 42 g/mol.
Pentru n(C X H y) = 1 mol m(C) = 42 0,857 = 36 g,
n(C) = 36 (g)/12 (g/mol) = 3 mol,
m(H) = 42 – 36 = 6 g,
n(H) = 6 (g)/1 (g/mol) = 6 mol.
Formula hidrocarbură este C3H6 (propenă).
Sarcina 3.Când se ard 4,2 g dintr-o substanță, se formează 13,2 g monoxid de carbon (IV) și 5,4 g apă. Densitatea vaporilor acestei substanțe în aer este de 2,9. Determinați compoziția moleculei de hidrocarbură.
Dat:
m(C X H y) = 4,2 g,
m(CO2) = 13,2 g,
m(H20) = 5,4 g,
D(aer) = 2,9.
Găsi: C X H y .
Soluţie
M(C X H y) = 2,9 29 = 84 g/mol.
Pentru a rezolva problema, să creăm o ecuație de reacție:
![]()
Să găsim masa X mol de CO 2 și cantitatea corespunzătoare de substanță:
m(CO2) = 84 13,2/4,2 = 264 g,
n(CO2) = 264 (g)/44 (g/mol) = 6 mol, X = 6.
De asemenea m(H20) = 84 5,4/4,2 = 108 g,
n(H20) = 108 (g)/18 (g/mol) = 6 mol, y = 12.
C 6 H 12 – hexenă.
Fiecare grup prezintă sarcinile pe care le-a finalizat pe bucăți de hârtie. Acesta este urmat de un rezumat al lecției.
Teme pentru acasă.Rudzitis G.E., Feldman F.G. Chimie-10. M.: Educația, 1999, capitolul IV, § 1, p. 30–38, fig. 10, p. 38. Pregătește întrebările 6, 7 din planul de studiere a temei lecției pentru seminar, învață materialul lecției-prelecție.
Muncă independentă
pe această temă:
eu opțiune
1. Hidrocarburile saturate se caracterizează prin următoarele reacții:
a) ardere, b) substituție, c) adiție. d) neutralizare?
2. Este dat un lanț de transformări
1 2 3
C2H6 → C2H5 Cl→ C4H10 → CO 2:
a doua reacție se numește a) Konovalov, b) Wurtz, c) Semenov.
Scrieți ecuațiile pentru toate reacțiile.
3.
Ce compus este folosit pentru a produce metan în laborator:
a) CH3COOH, b) CH 3OH, c) CH3C1, d) C H 3 SOO N A
Scrieți o ecuație pentru această reacție.
4.
Fracțiile de masă ale carbonului și hidrogenului dintr-o hidrocarbură sunt, respectiv, egale
82,76% și 17,24%.
Densitatea sa de vapori pentru hidrogen este 29. Deduceți formula substanței. Număratomii de hidrogen dintr-o moleculă sunt a) 12; b) 6; c) 10 d) 14.
„Proprietăți chimice și metode de obținere a alcanilor”
II opțiune
1. Care dintre următoarele proprietăți chimice sunt caracteristice metanului:
a) hidrogenare, b) izomerizare, c) ardere, d) oxidare catalitică?
Scrieți ecuațiile de reacție corespunzătoare.
2. Ca urmare a următoarelor transformări
Cl 2 hlN / A
CH 4 → X 1 → X 2
se formează produsul final (X 2 )
a) propan, b) cloretan, c) etan, d) clormetan?
Scrieți ecuațiile pentru toate reacțiile.
3.
Indicați ce compus este utilizat pentru a produce etan (în funcție de reacție
Wurtz): a) C 2H4, b) CH3 eu c) CH3-O-CH3, d) C2H5OH?
4.
Fracția de masă a carbonului din alcan este de 81,82%, hidrogen 18,18%. Relativ
densitatea sa de vapori în aer este de 1,518. Determinați formula alcanului. Numărul de atomi de carbon dintr-o moleculă de alcan este a) 4; b) 2; la 6; d) 3.
Dați doi omologi și doi izomeri pentru această hidrocarbură și dați-le nume.
Lucru independent pe tema:
„Proprietăți chimice și metode de obținere a alcanilor”
III opțiune
1. Indicați care dintre următoarele reacții sunt caracteristice butanului:
a) adiție, b) cracare, c) izomerizare, d) dehidrogenare.
Scrieți ecuațiile pentru aceste reacții.
2.
Ce reacție poate fi folosită pentru a obține metan în laborator:
a) CH 3 OH + H2 → b) CH3Br + N a →
c) CaC2 + H20 → g ) A14C3 + H20 →
Scrieți o ecuație pentru reacția corespunzătoare.
3. Indicați condițiile care sunt necesare pentru începerea reacției dintre etan și clor: a) răcire, b) încălzire, c) creșterea presiunii, d) iluminare. Scrieți o ecuație pentru reacția corespunzătoare
4. Fracțiile de masă ale carbonului și hidrogenului din hidrocarbură sunt de 81,8% și, respectiv, 18,2%. Densitatea sa de vapori pentru hidrogen este 22.
Numărul de atomi de hidrogen dintr-o moleculă a unei substanțe este a) 8; b) 6; la 3; d)12.
Dați doi omologi și doi izomeri pentru această hidrocarbură și dați-le nume.
Muncă independentă