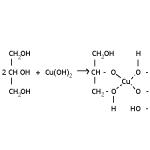
I denna ungefärliga beräkningsmetod beskrivs molekylens tillstånd av den så kallade vågfunktionen w, som är sammansatt enligt en viss regel av ett antal termer: Summan av dessa termer måste ta hänsyn till alla möjliga kombinationer som följer av den parvisa bindningen av kolatomer på grund av p-elektroner. Ofta är de givna valensscheman avbildade med hänsyn till y-bindningar, till exempel för bensen...
Metoder för att studera molekylers struktur (uppsats, kurser, diplom, prov)
1. Experimentella metoder
1.1 Röntgenelektronspektroskopi
1.2 Infraröd spektroskopi
1.3 Diffraktionsmetoder
2. Teoretiska metoder
2.1 Semi-empiriska metoder
2.2 Ursprungsmetoder
2.3 Kvantmekaniska metoder
2.4 Hückel-metod Slutsats Lista över använda källor
I modern organisk kemi stort värde har olika fysiska forskningsmetoder. De kan delas in i två grupper. I den första gruppen ingår metoder som gör det möjligt att få olika information om ett ämnes struktur och fysikaliska egenskaper utan att göra några kemiska förändringar i det. Av metoderna i denna grupp är den kanske mest använda spektroskopi i ett brett spektrum av spektralområden – från inte alltför hårda röntgenstrålar till radiovågor med inte särskilt långa våglängder. Den andra gruppen inkluderar metoder som använder fysisk påverkan som orsakar kemiska förändringar i molekyler. I senaste åren Nya har lagts till de tidigare använda välkända fysikaliska metoderna för att påverka en molekyls reaktivitet. Bland dem är effekterna av hårda röntgenstrålar och högenergipartikelflöden som produceras i kärnreaktorer av särskild betydelse.
Syftet med detta kursarbeteär att lära sig om metoder för att studera molekylers struktur.
Kursens mål:
Ta reda på vilka typer av metoder och studera dem.
1. EXPERIMENTELLA METODER
1.1 RRöntgenelektronspektroskopi
En metod för att studera den elektroniska strukturen av en kemisk förening, sammansättningen och strukturen av ytan av fasta ämnen, baserat på den fotoelektriska effekten med hjälp av röntgenstrålning. När ett ämne bestrålas absorberas ett röntgenkvantum hv (h-Plancks konstanta, v-frekvens av strålning), åtföljt av emission av en elektron (kallad fotoelektron) från atomens inre eller yttre skal. Bindningsenergin för en elektron E St i ett prov, i enlighet med lagen om energibevarande, bestäms av ekvationen: E St = hv-E kin, där E kin är fotoelektronens kinetiska energi. Eb-värdena för elektronerna i de inre skalen är specifika för en given atom, därför är det möjligt att entydigt bestämma den kemiska sammansättningen från dem. anslutningar. Dessutom återspeglar dessa kvantiteter arten av interaktionen mellan atomen som studeras med andra atomer i föreningen, dvs. de beror på den kemiska bindningens natur. Sammansättningen av provet bestäms av intensiteten I för fotoelektronflödet. Det schematiska diagrammet för enheten för XPS-elektronspektrometern visas i figur 1. Proverna bestrålas med röntgenstrålning från ett Reitgen-rör eller synkrotronstrålning. Fotoelektroner kommer in i en analysator, i vilken elektroner med en viss E-kin separeras från det allmänna flödet. Fokusering av ett monokromatiskt flöde av elektroner från analysatorn skickas till detektorn, där dess intensitet I bestäms. I röntgenelektronspektrumet har olika atomer sina egna intensitetsmaxima (Figur 2), även om vissa maxima kan smälta samman, vilket ger en. band med ökad intensitet. Spektrallinjer betecknas enligt följande: bredvid elementets symbol namnges den undersökta omloppsbanan (till exempel betyder notationen Cls att fotoelektroner registreras från kolets 1:a omloppsbana).
Figur 1—Elektronisk spektrometerdiagram: 1—strålningskälla; 2-prov; 3- analysator; 4-detektor; 5-skärm för skydd mot magnetfält Figur 2. Röntgenelektronspektrumet för Cls etyltrifluoroacetat XPS gör att man kan studera alla grundämnen utom H när deras innehåll i provet är ~ 10 -5 g (detektionsgränserna för grundämnet som använder XES är 10 -7 -10 - 9 g). Det relativa innehållet av ett grundämne kan vara en bråkdel av en procent. Prover kan vara fasta, flytande eller gasformiga. Värdet E St för elektronen i det inre skalet av en atom, A i kemiska föreningar beror på den effektiva laddningen q A på denna atom och den elektrostatiska potentialen U som skapas av alla andra atomer i föreningen: E St = kq A + U , där k är proportionalitetskoefficienten.
För enkelhetens skull introduceras konceptet med ett kemiskt skift Eb, lika med skillnaden mellan Eb i föreningen som studeras och en viss standard, i RES. Est-värdet som erhålls för den kristallina modifieringen av elementet används vanligtvis som standard; Till exempel, när man studerar förening S, används kristallint svavel som standard. Eftersom för ett enkelt ämne q A 0 och U = 0, då E St = kq A + U. Således indikerar ett kemiskt skifte en positiv effektiv laddning på atomen som studeras, A i en kemisk förening, och en negativ förskjutning indikerar en negativ laddning, och värdena på E St proportionella mot den effektiva laddningen på atomen. Eftersom förändringen i den effektiva laddningen på en atom, A, beror på dess oxidationstillstånd, arten av angränsande atomer och föreningens geometriska struktur, från Est kan man bestämma karaktären av funktionella grupper, oxidationstillståndet för atomen, metoden för koordinering av ligander etc. Bindningsenergierna för elektroner av funktionella atomgrupper är svaga beror på vilken typ av kemisk förening i vilken denna funktionella grupp är belägen.
1.2 OCHinfraröd spektroskopi
En gren av optisk spektroskopi som studerar absorptions- och reflektionsspektra av elektromagnetisk strålning i IR-området, dvs i våglängdsområdet från 10 -6 till 10 -3 m I koordinaterna intensiteten av absorberad strålning - våglängd (eller vågnummer). IR-spektrumet är komplex kurva med ett stort antal toppar och dalar. Absorptionsband uppträder som ett resultat av övergångar mellan vibrationsnivåer i det elektroniska marktillståndet i systemet som studeras. Spektrala egenskaper (positioner för bandmaxima, deras halva bredd, intensitet) för en individuell molekyl beror på massorna av dess ingående atomer, geometrisk struktur, egenskaper hos interatomiska krafter, laddningsfördelning, etc. Därför kännetecknas IR-spektra av stor individualitet , som bestämmer deras värde vid identifiering och studiestruktur av föreningar. För att registrera spektra används klassiska spektrofotometrar och Fourierspektrometrar. Huvuddelarna i en klassisk spektrofotometer är en källa för kontinuerlig termisk strålning, en monokromator och en icke-selektiv strålningsmottagare. En kyvett med ett ämne (i vilket som helst tillstånd av aggregation) placeras framför ingången (ibland bakom utgången) slitsen. Prismor gjorda av olika material (LiF, NaCl, KCl, CsF, etc.) och ett diffraktionsgitter används som en dispergeringsanordning för monokromatorn. Konsekutiv utmatning av strålning med olika våglängder till utgångsslitsen och strålningsmottagaren (avsökning) utförs genom att rotera prismat eller gittret. Strålningskällor är elektriskt uppvärmda stavar gjorda av olika material. Mottagare: känsliga termoelement, termiska motstånd av metall och halvledare (bolometrar) och gastermiska omvandlare, uppvärmning av kärlväggen leder till uppvärmning av gasen och en förändring i dess tryck, vilket registreras. Utsignalen ser ut som en vanlig spektralkurva. Fördelarna med enheter av den klassiska designen: enkel design, låg kostnad. Nackdelar: omöjlighet att spela in svaga signaler på grund av den låga signalen: brusförhållandet, vilket avsevärt komplicerar arbetet i den avlägsna IR-regionen; relativt låg upplösning (upp till 0,1 cm -1), långvarig (inom minuter) inspelning av spektra. Fourierspektrometrar har inga ingångs- eller utgångsslitsar, och huvudelementet är en interferometer. Strålningsflödet från källan delas upp i två strålar som passerar genom provet och stör. Skillnaden i strålarnas väg varieras av en rörlig spegel som reflekterar en av strålarna. Den initiala signalen beror på strålningskällans energi och på provets absorption och har formen av summan av ett stort antal övertonskomponenter. För att erhålla spektrumet i vanlig form utförs motsvarande Fouriertransform med hjälp av en inbyggd dator. Fördelar med en Fourier-spektrometer: hög signal: brusförhållande, förmåga att arbeta i ett brett spektrum av våglängder utan att ändra spridningselementet, snabb (i sekunder eller bråkdelar av sekunder) registrering av spektrumet, hög upplösning (upp till 0. 001 cm-1). Nackdelar: tillverkningens komplexitet och höga kostnader. Alla spektrofotometrar är utrustade med datorer som utför primär bearbetning av spektra: ackumulering av signaler, separation av dem från brus, subtraktion av bakgrunden och jämförelsespektrum (lösningsmedelsspektrum), ändra inspelningsskalan, beräkning av experimentella spektrala parametrar, jämförelse av spektra med givna, differentiering av spektra etc. Kyvetter för IR-spektrofotometrar är gjorda av material som är transparenta i IR-området. De lösningsmedel som vanligtvis används är CCl 4, CHCl 3, tetrakloretylen och vaselin. Fasta prover krossas ofta, blandas med KBr-pulver och pressas till tabletter. För att arbeta med aggressiva vätskor och gaser används speciellt skyddande beläggningar (Ge, Si) på kyvettfönstren. Den störande inverkan av luft elimineras genom att evakuera enheten eller tömma den med kväve. När det gäller svagt absorberande ämnen (förtärda gaser etc.) används flerpassagekyvetter, där den optiska väglängden når hundratals meter på grund av flera reflektioner från ett system av parallella speglar. Matrisisoleringsmetoden har blivit utbredd, där gasen som studeras blandas med argon och sedan fryses blandningen. Som ett resultat minskar halvbredden på absorptionsbanden kraftigt och spektrumet blir mer kontrasterande. Användningen av speciell mikroskopisk teknik gör det möjligt att arbeta med föremål av mycket små storlekar (bråkdelar av mm). För att registrera spektra av ytan av fasta ämnen, används metoden för dämpad total intern reflektion. Det är baserat på absorption ytskiktämne av elektromagnetisk strålningsenergi som kommer från ett total inre reflektionsprisma, som är i optisk kontakt med ytan som studeras. Infraröd spektroskopi används i stor utsträckning för analys av blandningar och identifiering av rena ämnen. Kvantitativ analys är baserad på Bouguer-Lambert-Beer-lagen, d.v.s. på beroendet av intensiteten hos absorptionsbanden på koncentrationen av ämnet i provet. I detta fall bedöms mängden ämne inte av individuella absorptionsband, utan av spektrala kurvor som helhet inom ett brett spektrum av våglängder. Om antalet komponenter är litet (4−5), är det möjligt att matematiskt isolera deras spektra även med betydande överlappning av de senare. Felet i kvantitativ analys är vanligtvis en bråkdel av en procent. Identifiering av rena ämnen utförs vanligtvis med hjälp av informationssökningssystem genom att automatiskt jämföra det analyserade spektrumet med spektra lagrade i datorns minne. För att identifiera nya ämnen (vars molekyler kan innehålla upp till 100 atomer) används system artificiell intelligens. I dessa system, baserat på spektrostrukturella korrelationer, genereras molära strukturer, sedan konstrueras deras teoretiska spektra och jämförs med experimentella data. Att studera strukturen hos molekyler och andra föremål med hjälp av infraröda spektroskopimetoder innebär att man skaffar information om parametrar för modeller och reduceras matematiskt till att lösa den sk. omvända spektralproblem. Lösningen på sådana problem utförs genom successiv approximation av de önskade parametrarna, beräknade med hjälp av specialverktyg. teorin om spektralkurvor till experimentella. Parametrar mol. Modellerna inkluderar massorna av atomerna som utgör systemet, bindningslängder, bindnings- och torsionsvinklar, egenskaper hos den potentiella ytan (kraftkonstanter, etc.), dipolmoment för bindningar och deras derivator med avseende på bindningslängder, etc. Infraröd spektroskopi gör det möjligt att identifiera rumsliga och konformationella isomerer och studera intra- och intermolekylära interaktioner, natur kemiska bindningar, laddningsfördelning i molekyler, fastransformationer, kinetik kemiska reaktioner, registrera kortlivade (livslängd upp till 10 -6 s) partiklar, förtydliga enskilda geomer. parametrar, erhålla data för beräkning av termodynamiska funktioner etc. Ett nödvändigt steg i sådan forskning är tolkningen av spektra, d.v.s. fastställa formen av normala vibrationer, fördelningen av vibrationsenergi över frihetsgrader, identifiera betydande parametrar som bestämmer positionen av banden i spektrat och deras intensiteter. Beräkningar av spektra av molekyler som innehåller upp till 100 atomer, inklusive polymerer, utförs med hjälp av en dator. I det här fallet är det nödvändigt att känna till pirens egenskaper. modeller (kraftkonstanter, elektrooptiska parametrar etc.), som hittas genom att lösa motsvarande inversa spektralproblem eller kvantkemiska beräkningar. I båda fallen är det vanligtvis möjligt att få data för molekyler som innehåller atomer från endast de fyra första perioderna periodiska systemet. Därför har infraröd spektroskopi som en metod för att studera molekylers struktur blivit mest utbredd inom organisk kemi och organoelementkemi. I vissa fall är det för gaser i IR-området möjligt att observera rotationsstrukturen hos vibrationsband. Detta gör att du kan beräkna dipolmoment och geomer. parametrar för molekyler, klargöra kraftkonstanter, etc.
1.3 Diffraktionsmetoder
Diffraktionsmetoder för att studera materiens struktur är baserade på studiet av vinkelfördelningen av intensiteten av spridning av ämnet som studeras av röntgenstrålning (inklusive synkrotronstrålning), elektron- eller neutronflöde. Det finns radiografi, elektrondiffraktion och neutrondiffraktion. I samtliga fall riktas en primär, oftast monokromatisk, stråle mot föremålet som studeras och spridningsmönstret analyseras. Spridd strålning registreras fotografiskt eller med hjälp av räknare. Eftersom strålningsvåglängden vanligtvis inte är mer än 0,2 nm, det vill säga jämförbar med avstånden mellan atomerna i ämnet (0,1–0,4 nm), är spridningen av den infallande vågen diffraktion med atomer. Utifrån diffraktionsmönstret är det i princip möjligt att rekonstruera ett ämnes atomära struktur. Teorin som beskriver sambandet mellan det elastiska spridningsmönstret och spridningscentras utrymme och placering är densamma för all strålning. Men eftersom växelverkan mellan olika typer av strålning med materia har olika fysikaliska egenskaper. karaktär, specifik typ och egenskaper av diffraktion. målningar bestäms olika egenskaper atomer. Därför ger olika diffraktionsmetoder information som kompletterar varandra.
Grunderna i diffraktionsteori . Platt monokromatisk. en våg med en våglängd och en vågvektor, där den kan betraktas som en stråle av partiklar med momentum, där amplituden för en våg spridd av en samling atomer bestäms av ekvationen:
Samma formel används för att beräkna atomfaktorn, som beskriver fördelningen av spridningstätheten inuti atomen. Atomfaktorvärdena är specifika för varje typ av strålning. Röntgenstrålar sprids av atomernas elektronskal. Motsvarande atomfaktor är numeriskt lika med antalet elektroner i en atom, om den uttrycks i namnet på elektroniska enheter, dvs. i relativa enheter av amplituden för röntgenspridning med en fri elektron. Elektronspridning bestäms av atomens elektrostatiska potential. Atomfaktorn för en elektron är relaterad av relationen:
forskningsmolekylspektroskopi diffraktionskvantum Figur 2 - Beroende av de absoluta värdena av atomfaktorer för röntgenstrålar (1), elektroner (2) och neutroner (3) på spridningsvinkeln Figur 3 - Relativt beroende av den vinkelmedelvärde atomen faktorer av röntgenstrålar (heldragen linje), elektroner (streckade) och neutroner från atomnummer Z
Noggranna beräkningar tar hänsyn till avvikelser av fördelningen av elektrondensitet eller potential hos atomer från sfärisk symmetri och namnet atomär temperaturfaktor, som tar hänsyn till inverkan av termiska vibrationer av atomer på spridning. För strålning, förutom spridning på atomers elektronskal, kan resonansspridning på kärnor spela en roll. Spridningsfaktorn f m beror på vågvektorerna och polarisationsvektorerna för de infallande och spridda vågorna. Intensiteten I(s) för spridning av ett föremål är proportionell mot kvadraten på amplituden: I (s)~|F (s)| 2. Endast modulerna |F(s)| kan bestämmas experimentellt, och för att konstruera spridningsdensitetsfunktionen ® är det också nödvändigt att känna till faserna för varje s. Icke desto mindre gör teorin om diffraktionsmetoder det möjligt att erhålla funktionen ® från de uppmätta I (s), det vill säga att bestämma strukturen av ämnen. I det här fallet erhålls de bästa resultaten när man studerar kristaller. Strukturanalys. En enkristall är ett strikt ordnat system, under diffraktion, bildas därför endast diskreta spridda strålar, för vilka spridningsvektorn är lika med den reciproka gittervektorn.
För att konstruera funktionen (x, y, z) från experimentellt bestämda värden används trial and error-metoden, konstruktion och analys av funktionen av interatomära avstånd, metoden för isomorfa substitutioner och direkta metoder för att bestämma faser. Bearbetning av experimentella data på en dator gör det möjligt att rekonstruera strukturen i form av spridningsdensitetskartor. Kristallstrukturer studeras med hjälp av röntgenstrukturanalys. Denna metod har bestämt mer än 100 tusen kristallstrukturer.
För oorganiska kristaller, med hjälp av olika förfiningsmetoder (med hänsyn till korrigeringar för absorption, anisotropi av atomtemperaturfaktorn, etc.), är det möjligt att återställa funktionen med en upplösning på upp till 0,05
Figur 4 - Nukleär densitetsprojektion kristallstruktur Detta gör det möjligt att bestämma anisoterapi av termiska vibrationer av atomer, egenskaper hos fördelningen av elektroner orsakade av kemiska bindningar etc. Med hjälp av röntgendiffraktionsanalys är det möjligt att dechiffrera atomstrukturerna hos proteinkristaller, vars molekyler innehåller tusentals atomer. Röntgendiffraktion används också för att studera defekter i kristaller (i röntgentopografi), studera ytskikt (i röntgenspektrometri) och kvalitativt och kvantitativt bestämma fassammansättningen av polykristallina material. Elektrondiffraktion som metod för att studera strukturen hos kristaller har följande. egenskaper: 1) interaktionen av materia med elektroner är mycket starkare än med röntgenstrålar, därför uppstår diffraktion i tunna lager av materia med en tjocklek på 1-100 nm; 2) f e beror på atomkärnan svagare än f p, vilket gör det lättare att bestämma positionen för lätta atomer i närvaro av tunga; Strukturell elektrondiffraktion används i stor utsträckning för att studera fint dispergerade föremål, samt för att studera olika typer av texturer (lermineraler, halvledarfilmer, etc.). Lågenergielektrondiffraktion (10 -300 eV, 0,1−0,4 nm) är en effektiv metod för att studera kristallytor: arrangemanget av atomer, arten av deras termiska vibrationer, etc. Elektronmikroskopi rekonstruerar bilden av ett föremål från diffraktionen mönster och låter dig studera strukturen av kristaller med en upplösning på 0,2 −0,5 nm. Neutronkällor för strukturanalys är kärnreaktorer med snabba neutroner, samt pulsade reaktorer. Spektrumet för neutronstrålen som kommer ut från reaktorkanalen är kontinuerligt på grund av den Maxwellska hastighetsfördelningen av neutroner (dess maximum vid 100 °C motsvarar en våglängd på 0,13 nm).
Strålmonokromatisering utförs på olika sätt - med hjälp av monokromatorkristaller etc. Neutrondiffraktion används som regel för att klargöra och komplettera röntgenstrukturdata. Frånvaron av ett monotont beroende av f och av atomnumret gör att man kan bestämma positionen för lätta atomer ganska exakt. Dessutom kan isotoper av samma grundämne ha mycket olika värden på f och (till exempel är f och kolväten 3.74.10 13 cm, för deuterium 6.67.10 13 cm). Detta gör det möjligt att studera arrangemanget av isotoper och få kompletterande information. strukturell information genom isotopsubstitution. Studie av magnetisk interaktion. neutroner med magnetiska moment av atomer ger information om spinn av magnetiska atomer. Mössbauer-strålningen kännetecknas av en extremt liten linjebredd - 10 8 eV (medan linjebredden för den karakteristiska strålningen från röntgenrör är 1 eV). Detta resulterar i en hög nivå av tid och rum. konsistens av resonanskärnspridning, vilket i synnerhet gör det möjligt att studera magnetfältet och gradienten elektriskt fält på kärnorna. Metodens begränsningar är den låga effekten hos Mössbauer-källor och den obligatoriska närvaron i kristallen som studeras av kärnor för vilka Mössbauer-effekten observeras. Strukturanalys av icke-kristallina ämnen. Enskilda molekyler i gaser, vätskor och amorfa fasta ämnen är olika orienterade i rymden, så det är vanligtvis omöjligt att bestämma faserna för spridda vågor. I dessa fall representeras spridningsintensiteten vanligtvis med hjälp av den sk. interatomära vektorer r jk, som förbinder par av olika atomer (j och k) i molekyler: r jk = r j - r k. Spridningsmönstret är ett medelvärde över alla orienteringar:
2 TEORETISKA METODER
2.1 Semi-empiriska metoder
Semi-empiriska metoder för kvantkemi, metoder för beräkning av mol. egenskaper eller egenskaper hos ett ämne med hjälp av experimentella data. I sin kärna liknar semi-empiriska metoder icke-empiriska metoder för att lösa Schrödinger-ekvationen för polyatomiska system, men för att underlätta beräkningar i semi-empiriska metoder, införs ytterligare tillägg. förenkling. Som regel är dessa förenklingar associerade med valensapproximationen, det vill säga de är baserade på beskrivningen av endast valenselektroner, såväl som med försummandet av vissa klasser av molekylära integraler i de exakta ekvationerna för den icke-empiriska metoden inom som den semi-empiriska beräkningen utförs.
Valet av empiriska parametrar bygger på en generalisering av erfarenheten av ab initio beräkningar, med hänsyn tagen till kemiska begrepp om molekylers struktur och fenomenologiska mönster. I synnerhet är dessa parametrar nödvändiga för att approximera påverkan av interna elektroner på valenselektroner, för att ställa in effektiva potentialer skapade av kärnelektroner, etc. Användningen av experimentella data för att kalibrera empiriska parametrar gör att vi kan eliminera fel orsakade av de förenklingar som nämns ovan, men endast för de klasser av molekyler, vars representanter tjänar som stödjande molekyler, och endast för de egenskaper genom vilka parametrarna bestämdes.
De vanligaste är semi-empiriska metoder baserade på idéer om mol. orbitaler (se Molecular orbital methods, Orbital). I kombination med LCAO-approximationen gör detta det möjligt att uttrycka Hamiltonian för en molekyl i termer av integraler på atomära orbitaler. Vid konstruktion av semi-empiriska metoder i mol. I integraler särskiljs produkter av orbitaler beroende på koordinaterna för samma elektron (differentiell överlappning) och vissa klasser av integraler försummas. Till exempel, om alla integraler som innehåller den differentiella överlappningen cacb för a anses vara noll. b, visar det sig att den sk. metod för att helt försumma differentialen. överlappning (PPDP, på engelska transkription CNDO-fullständig försummelse av differentiell överlappning). Partiell eller modifierad partiell försummelse av differentiell överlappning används också (respektive PPDP eller MCPDP, i Engelsk transkription INDO- intermediär negligering av differentiell överlappning och MINDO-modifierad INDO), negligering av diatomisk differentiell överlappning (NDDO), modifierad negligering av diatomisk överlappning (MNDO). Som regel har var och en av de semi-empiriska metoderna flera alternativ, som vanligtvis anges i metodens namn med en siffra eller bokstav efter ett snedstreck. Till exempel är PPDP/2, MCDP/3, MPDP/2-metoderna parametriserade för att beräkna jämviktskonfigurationen av molekylära kärnor i det elektroniska marktillståndet, laddningsfördelning, joniseringspotentialer, entalpier för bildning av kemiska föreningar, PPDP-metoden används för att beräkna spinndensiteter. För att beräkna elektroniska excitationsenergier används spektroskopisk parametrisering (PPDP/S-metoden). Det är också vanligt att använda motsvarande datorprogram i namn av semi-empiriska metoder. Till exempel kallas en av de utökade versionerna av MPDP-metoden Austin-modellen, liksom motsvarande program (Austin-modellen, AM). Det finns flera hundra olika alternativ semi-empiriska metoder, i synnerhet semi-empiriska metoder har utvecklats som liknarn. Med tanke på den externa likheten mellan olika versioner av semi-empiriska metoder, kan var och en av dem användas för att beräkna endast de egenskaper för vilka de empiriska parametrarna kalibrerades. I max. enkla semi-empiriska beräkningar, varje mol. orbitalen för valenselektroner definieras som lösningen av enelektronens Schrödinger-ekvation med Hamilton-operatorn som innehåller modellpotentialen (pseudopotential) för en elektron belägen i kärnans fält och medelfältet för alla andra elektroner i systemet. Denna potential ställs in direkt med hjälp av elementära funktioner eller integrerade operatörer baserade på dem. I kombination med LCAO-approximationen tillåter detta tillvägagångssätt många konjugerade och aromatiska mol. system, begränsa oss till analysen av p-elektroner (se Hückels metod för koordinationsföreningar, använda beräkningsmetoderna för ligandfältteorin och kristallfältsteorin etc. När man studerar till exempel makromolekyler). proteiner eller kristallina formationer används ofta semi-empiriska metoder, där den elektroniska strukturen inte analyseras, utan den potentiella energiytan bestäms direkt. Systemets energi betraktas ungefär som summan av parvisa interaktionspotentialer för till exempel atomer. Morse (Morse) eller Lennard-Jones potentialer (se Intermolekylära interaktioner). Sådana semi-empiriska metoder gör det möjligt att beräkna jämviktsgeometri, konformationseffekter, isomeriseringsenergi etc. Ofta kompletteras parpotentialer med multipartikelkorrigeringar specifika för enskilda fragment av molekylen. Semi-empiriska metoder av denna typ brukar benämnas molekylär mekanik. I en vidare mening inkluderar semi-empiriska metoder alla metoder där bestäms genom beslut omvända problem parametrar mol. system används för att förutsäga nya experimentella data och bygga korrelationsförhållanden. I denna mening är semi-empiriska metoder metoder för att bedöma reaktivitet, effektiva laddningar på atomer etc. Kombinationen av semi-empirisk beräkning av den elektroniska strukturen med korrelation. förhållanden låter dig utvärdera biologisk aktivitet olika ämnen, hastigheter för kemiska reaktioner, parametrar för tekniska processer. Semi-empiriska metoder inkluderar även vissa additivsystem, till exempel. metoder som används inom kemisk termodynamik för att uppskatta bildningsenergin som summan av bidragen från enskilda fragment av molekylen. Den intensiva utvecklingen av semi-empiriska metoder och icke-empiriska metoder för kvantkemi gör dem viktiga medel modern forskning kemiska mekanismer transformationer, dynamik i en elementär kemisk handling. reaktioner, modellering av biokemiska och tekniska processer. När de används korrekt (med hänsyn till principerna för konstruktion och metoder för kalibrering av parametrar), gör semi-empiriska metoder det möjligt att erhålla tillförlitlig information om strukturen och egenskaperna hos molekyler och deras transformationer.
2.2Icke-empiriska metoder
En fundamentalt annorlunda riktning av beräkningskvantumkemi, som spelade en stor roll i modern utveckling kemi i allmänhet, består i en fullständig eller partiell vägran att beräkna en-elektron (3.18) och två-elektron (3.19)-(3.20) integraler som förekommer i HF-metoden. Istället för den exakta Fock-operatorn används en ungefärlig sådan, vars element erhålls empiriskt. Parametrarna för Fock-operatorn väljs för varje atom (ibland med hänsyn till en specifik miljö) eller för par av atomer: de är antingen fixerade eller beror på avståndet mellan atomerna. I det här fallet antas det ofta (men inte nödvändigtvis - se nedan) att många-elektronvågsfunktionen är endeterminant, basen är minimal och atomorbitalerna är X; - symmetriska ortogonala kombinationer av OST Xg Sådana kombinationer kan enkelt erhållas genom att approximera den ursprungliga AO med Slater-funktioner "Xj(2.41) med hjälp av transformationen Semi-empiriska metoder är mycket snabbare än ab initio. De är tillämpliga på stora (ofta mycket stora, till exempel biologiska) system och för vissa klasser av föreningar ger de mer exakta resultat. Det bör dock förstås att detta uppnås genom speciellt utvalda parametrar som endast är giltiga inom en snäv klass av föreningar. Vid överföring till andra föreningar kan samma metoder ge helt felaktiga resultat. Dessutom väljs ofta parametrar för att endast reproducera vissa molekylära egenskaper, så det är inte nödvändigt att tilldela fysisk betydelse till enskilda parametrar som används i beräkningsschemat. Låt oss lista de huvudsakliga approximationerna som används i semi-empiriska metoder.
1. Endast valenselektroner beaktas. Man tror att elektroner som hör till atomkärnor bara screenar kärnorna. Därför beaktas inflytandet av dessa elektroner genom att överväga interaktionen av valenselektroner med atomkärnor, snarare än med kärnor, och genom att introducera kärnrepulsionsenergin istället för den internukleära repulsionsenergin. Polariseringen av kärnorna försummas.
2. I MO tas endast hänsyn till AOs med ett huvudsakligt kvantantal som motsvarar de högsta elektronupptagna orbitalen av isolerade atomer (minimumbasis). Det antas att basfunktionerna bildar en uppsättning ortonormala atomorbitaler - OCT, ortogonaliserade enligt Löwdin.
3. För Coulomb- och utbytesintegraler med två elektroner introduceras approximationen av nolldifferentialöverlappning (NDO).
Den molekylära strukturen inom det strukturella området kan motsvara en uppsättning modifieringar av molekylen som bibehåller samma system av valenskemiska bindningar med olika rumslig organisation av kärnorna. I detta fall har det djupa minimum av PES dessutom flera grunda (ekvivalenta eller icke-ekvivalenta energi) minima, åtskilda av små potentiella barriärer. Olika rumsliga former av en molekyl, som omvandlas till varandra inom en given strukturell region genom att kontinuerligt ändra koordinaterna för atomer och funktionella grupper utan att bryta eller bilda kemiska bindningar, utgör molekylens många konformationer. En uppsättning konformationer vars energier är mindre än den lägsta barriären intill en given strukturell region av PES kallas en konformationell isomer eller konformer. Konformerar som motsvarar lokala minima för PES kallas stabila eller stabila. Molekylstruktur kan således definieras som uppsättningen av konformationer av en molekyl i ett visst strukturellt område. En typ av konformationsövergång som ofta finns i molekyler är rotationen av enskilda grupper av atomer kring bindningar: intern rotation sägs förekomma, och den. olika konformers kallas rotationsisomerer eller rotamerer. Under rotation förändras också den elektroniska energin, och dess värde under sådan rörelse kan passera genom ett maximum; i detta fall talar vi om en intern rotationsbarriär. De senare beror till stor del på dessa molekylers förmåga att enkelt anpassa strukturen när de interagerar med olika system. Varje energiminimum av PES motsvarar ett par enantiomerer med samma energi - höger ® och vänster (S). Dessa par har energier som bara skiljer sig med 3,8 kcal/mol, men de är åtskilda av en barriär med en höjd på 25,9 kcal/mol och är därför mycket stabila i frånvaro av yttre påverkan. Resultat av kvantkemiska beräkningar av inre rotationsbarriärenergier för vissa molekyler och motsvarande experimentella värden. Teoretiska och experimentella värden av rotationsbarriärer för C-C anslutningar, C-P, C-S skiljer sig endast med 0,1 kcal/mol; för C-0, C-N, C-Si-bindningarna, trots användningen av en basuppsättning med inkluderandet av polarisationsfunktioner (se nedan), är skillnaden märkbart högre. Vi kan dock konstatera att interna rotationsbarriärers energier beräknas med tillfredsställande noggrannhet med HF-metoden.
Förutom spektroskopiska tillämpningar är sådana beräkningar av inre rotationsbarriärenergier för enkla molekyler viktiga som ett kriterium för kvaliteten på en viss beräkningsmetod. Intern rotation förtjänar stor uppmärksamhet i komplexa molekylära system, till exempel i polypeptider och proteiner, där denna effekt bestämmer många biologiskt viktiga funktioner hos dessa föreningar. Beräkningen av potentiella energiytor för sådana objekt är svår uppgift både teoretiskt och rent praktiskt . En vanlig typ av konformationsövergång är inversion, såsom den förekommer i pyramidformiga molekyler av AX3-typ (A = N, Si, P, As, Sb; X = H, Li, F, etc.). I dessa molekyler kan atom A inta positioner både över och under planet som bildas av tre X-atomer. Till exempel, i ammoniakmolekylen NH3, ger HF-metoden ett energibarriärvärde på 23,4 kcal/mol. detta stämmer väl överens med det experimentella värdet av inversionsbarriären – 24,3 kcal/mol. Om barriärerna mellan PES-minima är jämförbara med molekylens termiska energi, leder detta till effekten av strukturell icke-styvhet hos molekylen; Konformationsövergångar i sådana molekyler sker konstant. För att lösa HF-ekvationerna används den självständiga fältmetoden. I lösningsprocessen optimeras endast de orbitaler som är upptagna av elektroner, därför finns energierna för endast dessa orbitaler fysiskt berättigade. Dock metoden. HF ger också egenskaperna hos fria orbitaler: sådana molekylära spinorbitaler kallas virtuella. Tyvärr beskriver de de exciterade energinivåerna för en molekyl med ett fel på cirka 100 %, och de bör användas med försiktighet för att tolka spektroskopiska data - det finns andra metoder för detta. Såväl som för atomer har HF-metoden för molekyler olika versioner, beroende på om den singeldeterminanta vågfunktionen är en egenfunktion av operatorn för kvadraten av det totala spinnet i systemet S2 eller inte. Om vågfunktionen är konstruerad från rumsliga orbitaler upptagna av ett elektronpar med motsatta spinn (closed-shell molecules), är detta villkor uppfyllt, och metoden kallas den begränsade Hartree-Fock-metoden (HRF). Om kravet på att vara en egenfunktion för operatorn inte ställs på vågfunktionen, så motsvarar varje molekylär spin-orbital ett specifikt spinntillstånd (a eller 13), det vill säga elektroner med motsatta spins upptar olika spin-orbitaler. Denna metod används vanligtvis för molekyler med öppna skal och kallas för den obegränsade HF-metoden (UHF), eller metoden för olika orbitaler för olika snurr. Ibland beskrivs lågt liggande energitillstånd av orbitaler som är dubbelt upptagna av elektroner, och valenstillstånd beskrivs av enbart ockuperade molekylära spinorbitaler; Denna metod kallas den begränsade Hartree-Fock-metoden för öppna skal (OHF-00). Liksom i atomer motsvarar vågfunktionen hos molekyler med öppna skal inte ett rent spinntillstånd, och det kan uppstå lösningar där vågfunktionens spinnsymmetri reduceras. De kallas NHF-instabila lösningar.
2.3 Kvantmekaniska metoder
Framsteg inom teoretisk kemi, utveckling kvantmekanik skapat möjligheten till ungefärliga kvantitativa beräkningar av molekyler. Det finns två viktiga beräkningsmetoder: elektronparmetoden, även kallad valensbindningsmetoden, och molekylorbitalmetoden. Den första av dessa metoder, utvecklad av Heitler och London för vätemolekylen, blev utbredd på 30-talet av detta århundrade. På senare år har metoden med molekylär omlopp blivit allt viktigare (Gund, E. Hückel, Mulliken, Hertzberg, Lenard-Jones).
I denna ungefärliga beräkningsmetod beskrivs molekylens tillstånd av den så kallade vågfunktionen w, som är sammansatt enligt en viss regel av ett antal termer:
Summan av dessa termer måste ta hänsyn till alla möjliga kombinationer som är ett resultat av den parvisa bindningen av kolatomer på grund av p-elektroner.
För att underlätta beräkningen av vågfunktionen w är individuella termer (C1w1, C2w2, etc.) konventionellt avbildade grafiskt i form av motsvarande valensscheman, som används som hjälpmedel vid matematiska beräkningar. Till exempel, när en bensenmolekyl beräknas med den angivna metoden och endast p-elektroner tas med i beräkningen, erhålls fem sådana termer. Dessa termer motsvarar följande valensscheman:
De givna valensscheman är ofta avbildade med hänsyn till y-bindningar, till exempel för bensen. Sådana valensscheman kallas "oberoende strukturer" eller "begränsande strukturer".
Funktionerna w1, w2, w3 etc. för olika begränsande strukturer ingår i vågfunktionen w med de större koefficienterna (med ju större vikt) desto lägre energi beräknas för motsvarande struktur. Det elektroniska tillståndet som motsvarar vågfunktionen w är det mest stabila jämfört med de elektroniska tillstånden som representeras av funktionerna w1, w2, w3, etc.; energin i det tillstånd som representeras av funktionen w (av en verklig molekyl) är naturligtvis den minsta jämfört med energierna i de begränsande strukturerna.
Vid beräkning av bensenmolekylen med elektronparmetoden beaktas fem begränsande strukturer (I--V). Två av dem är identiska med den klassiska Kekule-strukturformeln och tre-Dewar-formeln. Eftersom energin för de elektroniska tillstånden som motsvarar de begränsande strukturerna III, IV och V är högre än för strukturerna I och II, är bidraget från strukturerna III, IV och V till den blandade vågfunktionen hos bensenmolekylen mindre än bidraget från strukturerna I och II. Därför, till en första approximation, är två ekvivalenta Kekulé-strukturer tillräckliga för att avbilda elektrondensitetsfördelningen i en bensenmolekyl.
För ungefär trettio år sedan utvecklade L. Pauling kvalitativa empiriska idéer som har vissa analogier med elektronparmetoden; Dessa idéer kallades av honom teorin om resonans. Enligt huvudpostulatet för denna teori kan varje molekyl för vilken flera klassiska strukturformler kan skrivas inte representeras korrekt av någon av dessa individuella formler (begränsande strukturer), utan endast av en uppsättning av dem. Den kvalitativa bilden av elektrondensitetsfördelningen i en verklig molekyl beskrivs av en överlagring av begränsande strukturer (som var och en representeras med en viss vikt).
Gränsstrukturer motsvarar inte någon verklig elektroniska tillstånd i oexciterade molekyler är det dock möjligt att de kan förekomma i ett exciterat tillstånd eller vid tidpunkten för reaktionen.
Ovanstående kvalitativa sida av resonansteorin sammanfaller med begreppet mesomerism, något tidigare utvecklat av Ingold och oberoende av Arndt.
Enligt detta koncept är det sanna tillståndet för en molekyl mellanliggande ("mesomerisk") mellan tillstånden som avbildas av två eller flera "gränsstrukturer" som kan skrivas för en given molekyl med valensreglerna.
Förutom denna grundläggande ställning i teorin om mesomerism, inkluderar dess apparat välutvecklade idéer om elektroniska förskjutningar, i motiveringen, tolkningen och experimentell verifiering av vilka viktig roll tillhör Ingold. Enligt Ingold är mekanismerna för elektroniska förskjutningar (elektroniska effekter) olika beroende på om atomernas ömsesidiga påverkan sker genom en kedja av enkla eller konjugerade dubbelbindningar. I det första fallet är detta induktionseffekten I (eller även den statiska induktionseffekten Is), i det andra fallet den mesomeriska effekten M (statisk konjugationseffekt).
I en reagerande molekyl kan elektronmolnet polariseras av en induktiv mekanism; denna elektroniska förskjutning kallas den induktomera effekten Id. I molekyler med konjugerade dubbelbindningar(och i aromatiska molekyler) beror elektronmolnets polariserbarhet vid reaktionsögonblicket på den elektromeriska effekten E (dynamisk konjugationseffekt).
Resonansteorin ger inga grundläggande invändningar så länge som vi pratar om om sätt att avbilda molekyler, men hon har också stora anspråk. I likhet med hur vågfunktionen i elektronparmetoden beskrivs av en linjär kombination av andra vågfunktioner w1, w2, w3, etc., föreslår resonansteorin att beskriva en molekyls sanna vågfunktion som en linjär kombination av vågfunktioner hos begränsande strukturer.
Matematik ger dock inga kriterier för att välja vissa "resonansstrukturer": trots allt, i elektronparmetoden, kan vågfunktionen representeras inte bara som en linjär kombination av vågfunktioner w1, w2, w3, etc., utan också som en linjär kombination av alla andra funktioner, valda med vissa koefficienter. Valet av begränsande strukturer kan endast göras utifrån kemiska överväganden och analogier, d.v.s. här ger resonansbegreppet i huvudsak inget nytt i jämförelse med begreppet mesomerism.
När man beskriver fördelningen av elektrondensitet i molekyler med hjälp av gränsstrukturer är det nödvändigt att hela tiden ha i åtanke att individuella gränsstrukturer inte motsvarar någon verklig fysiskt tillstånd och att inget fysiskt fenomen med "elektronisk resonans" existerar.
Många fall är kända från litteraturen när anhängare av begreppet resonans tillskrev betydelsen av ett fysiskt fenomen till resonans och trodde att vissa individuella begränsande strukturer var ansvariga för vissa egenskaper hos ämnen. Möjligheten till sådana missuppfattningar är inneboende i många punkter i begreppet resonans. Sålunda, när de talar om "olika bidrag av begränsande strukturer" till molekylens verkliga tillstånd, kan idén om den verkliga existensen av dessa relationer lätt uppstå. En verklig molekyl i resonansbegreppet anses vara en "resonanshybrid"; denna term kan antyda den förment verkliga interaktionen av begränsande strukturer, som hybridisering av atomära banor.
Termen "stabilisering på grund av resonans" är också misslyckad, eftersom stabiliseringen av en molekyl inte kan orsakas av en icke-existerande resonans, utan är ett fysiskt fenomen av delokalisering av elektrontätheten, karakteristiskt för konjugerade system. Det är därför lämpligt att kalla detta fenomen för stabilisering på grund av konjugering. Konjugationsenergin (delokaliseringsenergi eller mesomerismenergi) kan bestämmas experimentellt, oberoende av "resonansenergin" som resulterar från kvantmekaniska beräkningar. Detta är skillnaden mellan energin som beräknas för en hypotetisk molekyl med en formel som motsvarar en av de begränsande strukturerna, och den energi som experimentellt hittas för en riktig molekyl.
Med ovanstående reservationer kan metoden att beskriva fördelningen av elektrondensitet i molekyler med användning av flera begränsande strukturer utan tvekan användas tillsammans med två andra också mycket vanliga metoder.
2.4 Hückel metod
Hückel-metod, kvantkemisk metod för ungefärlig beräkning energinivåer och de säger orbitaler av omättade org. anslutningar. Det är baserat på antagandet att rörelsen av en elektron nära en atomkärna i en molekyl inte beror på tillstånden eller antalet andra elektroner. Detta gör det möjligt att förenkla uppgiften att bestämma mol. orbitaler (MO) representerade av en linjär kombination av atomära orbitaler. Metoden föreslogs av E. Hückel 1931 för att beräkna den elektroniska strukturen hos kolväten med konjugerade bindningar. Man tror att kolatomerna i ett konjugerat system ligger i samma plan, i förhållande till vilket de högsta ockuperade och lägsta virtuella (fria) MO:erna (gränsmolekylära orbitaler) är antisymmetriska, det vill säga de är orbitaler som bildas av atomära 2pz orbitaler (AO) ) av motsvarande C-atomer Inverkan av andra atomer, till exempel. N eller mol. fragment med mättade anslutningar försummas. Det antas att var och en av M kolatomerna i det konjugerade systemet bidrar med en elektron till systemet och beskrivs av en atomär 2pz orbital (k = 1, 2, ..., M). En enkel modell av en molekyls elektroniska struktur, som ges av Hückel-metoden, gör att vi kan förstå många kemiska reaktioner. fenomen. Till exempel beror opolariteten hos alternativa kolväten på det faktum att de effektiva laddningarna på alla kolatomer är lika med noll. Däremot har det icke-alternerande smälta systemet med 5- och 7-ledade ringar (azulen) ett dipolmoment på ca. ID (3,3 x 10-30 C x m). I udda alternativa kolväten är den huvudsakliga energikällan. tillståndet motsvarar ett elektroniskt system där det finns minst en enstaka omloppsbana. Det kan visas att energin i denna orbital är densamma som i en fri atom, och därför kallas den. icke-bindande MO. Att ta bort eller lägga till en elektron ändrar populationen av endast den icke-bindande orbitalen, vilket medför uppkomsten av en laddning på vissa atomer, som är proportionell mot kvadraten på motsvarande koefficient i expansionen av den icke-bindande MO i AO. För att bestämma en sådan MO används en enkel regel: summan av koefficienten Ck för alla atomer som gränsar till alla data måste vara lika med noll. Dessutom måste koefficientvärdena motsvara tillägget normaliseringstillstånd: Detta leder till en karakteristisk växling (växling) av laddningar på atomer i mol. joner av alternativa kolväten. Denna regel förklarar särskilt separationen med kemikalier. egenskaper hos orto- och parapositionerna i bensenringen jämfört med metapositionen. De regelbundenheter som fastställts inom ramen för den enkla Hückel-metoden förvrängs när alla interaktioner i molekylen mer fullständigt beaktas. Men vanligtvis påverkan av många olika faktorer (till exempel kärnelektroner, substituenter, interelektronrepulsion, etc.) etc.) ändrar inte kvalitativt orbitalbilden av elektronfördelningen. Därför används Hückel-metoden ofta för att modellera komplexa reaktionsmekanismer som involverar org. anslutningar. När heteroatomer (N, O, S, ...) införs i molekylen blir parametrarna för matrisen H som tas för heteroatomen och för kolatomer signifikanta. Till skillnad från fallet med polyener beskrivs olika typer av atomer eller bindningar olika parametrar eller och deras förhållande påverkar signifikant typen av MO; Kvaliteten på förutsägelser som erhålls inom ramen för den enkla Hückel-metoden försämras som regel i slutändan. Enkel i konceptet, visuell och kräver inte komplexa beräkningar, Hückel-metoden är ett av de vanligaste sätten att skapa en kvantkemisk modell av den elektroniska strukturen hos komplexa molekyler. system Naib. Dess användning är effektiv i fall där egenskaperna hos molekylen bestäms av kemikaliens grundläggande topologiska struktur. bindningar, särskilt molekylens symmetri. Försök att konstruera förbättrade versioner av Hückel-metoden inom ramen för enkla molekylära orbitalmetoder är inte meningsfulla, eftersom de leder till beräkningsmetoder som i komplexitet är jämförbara med kvantkemins mer exakta metoder.
Slutsats
För närvarande "har en hel gren av vetenskap skapats - kvantkemi, som handlar om tillämpningen av kvantmekaniska metoder på kemiska problem. Det skulle dock vara fundamentalt felaktigt att tro att alla frågor om organiska föreningars struktur och reaktivitet kan reduceras till problem med kvantmekanik. Kvantmekaniken studerar rörelselagarna för elektroner och kärnor, d.v.s. lagarna för den lägsta formen av rörelse, i jämförelse med den som studeras av kemi (atomernas och molekylernas rörelse), och den högsta formen av rörelse kan aldrig reduceras till det lägsta. Även för mycket enkla molekyler kan frågor som ämnens reaktivitet, mekanismen och kinetiken för deras transformationer inte endast studeras med kvantmekanikens metoder. Grunden för att studera materiens kemiska rörelseform är kemiska metoder forskning, och den ledande rollen i utvecklingen av kemi tillhör teorin om kemisk struktur.
Lista källor som används
1. Minkin, V.I. Teori om molekylernas struktur / V.I. -M.: Högre skola, 2006- 640 sid.
2. Vilkov, L.V. Fysiska metoder forskning i kemi./ L. V. Vilkov, Yu A. Pentin. - M.: Högre skola, 2005−380.
3. Gardymova, A.P. Scientific elektroniskt bibliotek: element och enheter för datorteknik och styrsystem / A. P. Gardymova. — 2005.
4. Elyashevich, M. A. Atom- och molekylspektroskopi / M. A. Elyashevich, V. Demtreder. -M.: Mir, 1989−260-talet.
5. Blatov, V. A. Semi-empiriska beräkningsmetoder / V. A. Blatov, A. P. Shevchenko. — M.: ”Univers-gruppen” 2005−315 sid.
6. Tsirelson, V. G. Kvantkemi, molekyler, molekylära system och fasta ämnen-M.: ”BINOM” 2010−496 sid.
Beroende på finstrukturen.
För närvarande, för att studera strukturen hos organiska föreningar, används studiet av deras infraröda, synliga och ultravioletta absorptionsspektra i stor utsträckning. Infraröda och Ramanspektra är förknippade med vibrations- och rotationsrörelser(mer exakt kärnor), de synliga och ultravioletta spektra har sitt ursprung till elektroniska övergångar.
Eftersom enskilda radikaler (till exempel OH, NH 2, NO 2, CO, C 6 H 5, etc.), samt separata anslutningar inuti , (till exempel C=C, C≡C, C=O, C-H, etc.) motsvarar vissa karakteristiska frekvenser i infraröd, spektra och Raman-spektra (som varierar lite från förening till förening), sedan enligt dessa spektra kan användas för att bedöma förekomsten av vissa radikaler eller bindningar.
Raman effekt, Samtidigt upptäcktes 1928 av de sovjetiska fysikerna G. S. Landsberg och L. O. Mandelstam och den indiske vetenskapsmannen C. V. Raman, att när den belyses av en stark källa av monokromatiskt ljus (till exempel en kraftfull kvicksilverlampa med ett filter som sänder ut den violetta linjen 4047 Å) i spektrumet av spritt ljus, tillsammans med linjen som har en frekvens ν 0 av det infallande ljuset, observeras svaga linjer - satelliter, förskjutna lika mycket i båda riktningarna, med frekvenser ν 0 - ν " och, ν 0 + ν " , ν 0 -ν " och ν 0 + ν " , ν 0 -ν "" och ν 0 + ν "" etc. Dessa symmetriska satelliter skiljer sig emellertid åt i sin intensitet: intensiteten hos linjer med frekvenser större än ν 0 är mycket svagare, och deras observation är mycket svår. Därför talar de i princip om ett system av satelliter ν 0 -ν " ν 0 -ν " , ν 0 -ν " etc. Det visar sig att frekvensskiftvärdena (ν " , ν " , ν "" . . .) motsvarar övergångar av en given en från en vibrationsnivå till en annan, dvs de motsvarar naturliga vibrationer, uppstår i . Dessa förskjutningsvärden beror inte på frekvensen ν 0 för det infallande ljuset.
Många av problemen som diskuterats ovan kan också lösas med hjälp av infraröda spektra.

I fig. 55 visar hur olika de infraröda spektra är relativt småpengar deras strukturer. I infraröda spektra, som i Raman-spektra, motsvarar enskilda radikaler och bindningar vissa karakteristiska frekvenser, vilket ofta gör det möjligt att välja den mest rimliga strukturen för en förening som erhålls för första gången. Dessutom kräver att erhålla infraröda spektra mindre tid än att förvärva Raman-spektra. Därför är vissa problem med att etablera strukturen ofta lättare att lösa med den infraröda spektrametoden. Men i de flesta fall är det lättare och mer subtilt att producera med Raman-spektra. Dessutom uppträder många karakteristiska linjer för enskilda grupper och anslutningar antingen endast i det infraröda spektrat
pax, eller i Raman-spektra. Således kompletterar dessa två metoder varandra.
Den mer frekventa användningen av metoder av utländska kemister förklaras endast av det faktum att deras länder inte har etablerat produktion av metoder som är tillräckligt avancerade för att utföra korrekta studier med Raman-spektra.
Absorptionsspektra i de synliga och ultravioletta områdena gör det också möjligt att lösa de ovan nämnda problemen. Men inte alla, utan främst föreningar som innehåller ett stort antal, har absorption i denna region av spektrumet.
Studiet av ämnen är en ganska komplex och intressant fråga. När allt kommer omkring finns de nästan aldrig i naturen i sin rena form. Oftast är dessa blandningar av komplex sammansättning, där separationen av komponenter kräver vissa ansträngningar, färdigheter och utrustning.
Efter separation är det lika viktigt att korrekt avgöra om ett ämne tillhör en viss klass, det vill säga att identifiera det. Bestäm kok- och smältpunkter, beräkna molekylvikt, testa för radioaktivitet och så vidare, i allmänhet, forskning. Olika metoder används för detta, bl.a fysikalisk-kemiska metoder analys. De är ganska olika och kräver vanligtvis användning av specialutrustning. De kommer att diskuteras vidare.
Fysikalisk-kemiska analysmetoder: allmänt begrepp
Vilka är dessa metoder för att identifiera föreningar? Dessa är metoder som är baserade på det direkta beroendet av alla fysikaliska egenskaper hos ett ämne på dess strukturella kemisk sammansättning. Eftersom dessa indikatorer är strikt individuella för varje förening, är fysikaliska och kemiska forskningsmetoder extremt effektiva och ger 100% resultat vid bestämning av sammansättningen och andra indikatorer.
Således kan följande egenskaper hos ett ämne tas som grund:
- ljusabsorptionsförmåga;
- värmeledningsförmåga;
- elektrisk ledningsförmåga;
- kokpunkt;
- smältning och andra parametrar.
Fysikalisk-kemiska forskningsmetoder har en betydande skillnad från rent kemiska metoder för att identifiera ämnen. Som ett resultat av deras arbete sker ingen reaktion, det vill säga omvandlingen av ett ämne, varken reversibelt eller irreversibelt. Som regel förblir föreningarna intakta både i massa och sammansättning.

Funktioner hos dessa forskningsmetoder
Det finns flera huvuddrag som är karakteristiska för sådana metoder för att bestämma ämnen.
- Forskningsprovet behöver inte rengöras från föroreningar före ingreppet, eftersom utrustningen inte kräver detta.
- Fysikalisk-kemiska analysmetoder har hög grad känslighet, samt ökad selektivitet. Därför krävs en mycket liten mängd av testprovet för analys, vilket gör dessa metoder mycket bekväma och effektiva. Även om det är nödvändigt att bestämma ett element som ingår i den totala våta massan i försumbara mängder, är detta inte ett hinder för de angivna metoderna.
- Analysen tar bara några minuter, så en annan funktion är dess korta varaktighet, eller uttrycklighet.
- De forskningsmetoder som övervägs kräver inte användning av dyra indikatorer.
Uppenbarligen är fördelarna och funktionerna tillräckligt för att göra fysikalisk-kemiska forskningsmetoder universella och efterfrågade i nästan alla studier, oavsett verksamhetsområde.

Klassificering
Flera egenskaper kan identifieras utifrån vilka metoderna i fråga klassificeras. Vi kommer dock att ge det mesta gemensamt system, som förenar och täcker alla huvudmetoder för forskning som är direkt relaterade till fysikalisk-kemiska.
1. Elektrokemiska metoder forskning. Baserat på den uppmätta parametern är de indelade i:
- potentiometri;
- voltammetri;
- polarografi;
- oscillometri;
- konduktometri;
- elektrogravimetri;
- coulometri;
- amperometri;
- dielometri;
- högfrekvent konduktometri.
2. Spektral. Omfatta:
- optisk;
- Röntgenfotoelektronspektroskopi;
- elektromagnetisk och kärnmagnetisk resonans.
3. Termisk. Uppdelat i:
- termisk;
- termogravimetri;
- kalorimetri;
- entalpimetri;
- delatometry.
4. Kromatografiska metoder, som är:
- gas;
- sedimentär;
- gelpenetrerande;
- utbyta;
- flytande.
Det är också möjligt att dela upp fysikalisk-kemiska analysmetoder i två stora grupper. De första är de som resulterar i förstörelse, det vill säga fullständig eller partiell förstörelse av ett ämne eller element. Den andra är oförstörande och bevarar integriteten hos testprovet.

Praktisk tillämpning av sådana metoder
Användningsområdena för de aktuella arbetsmetoderna är ganska olika, men alla avser givetvis vetenskap eller teknik på ett eller annat sätt. I allmänhet kan vi ge flera grundläggande exempel, från vilka det kommer att framgå varför exakt sådana metoder behövs.
- Kontroll över flödet av komplexa tekniska processer i produktionen. I dessa fall är utrustning nödvändig för beröringsfri styrning och spårning av alla strukturella länkar i arbetskedjan. Samma instrument kommer att registrera problem och fel och tillhandahålla en korrekt kvantitativ och kvalitativ rapport om korrigerande och förebyggande åtgärder.
- Utför kemikalier praktiskt arbete i syfte att kvalitativ och kvantitativ bestämning av utbytet av reaktionsprodukten.
- Undersökning av ett prov av ett ämne för att fastställa dess exakta grundämnessammansättning.
- Bestämning av mängden och kvaliteten på föroreningar i provets totala massa.
- Noggrann analys av intermediära, huvudsakliga och sekundära deltagare i reaktionen.
- En detaljerad rapport om ett ämnes struktur och de egenskaper det uppvisar.
- Upptäckt av nya element och erhållande av data som kännetecknar deras egenskaper.
- Praktisk bekräftelse av teoretiska data erhållna empiriskt.
- Analytiskt arbete med högrena ämnen som används inom olika teknikområden.
- Titrering av lösningar utan användning av indikatorer, vilket ger ett mer exakt resultat och har helt enkel kontroll, tack vare enhetens funktion. Det vill säga påverkan mänsklig faktor kommer ner till noll.
- Grundläggande fysikalisk-kemiska analysmetoder gör det möjligt att studera sammansättningen av:
- mineraler;
- mineraler;
- silikater;
- meteoriter och främmande kroppar;
- metaller och icke-metaller;
- legeringar;
- ekologiska och icke organiskt material;
- enkelkristaller;
- sällsynta och spårämnen.
Användningsområden för metoder
- kärnenergi;
- fysik;
- kemi;
- radioelektronik;
- laserteknik;
- rymdforskning och andra.
Klassificeringen av fysikalisk-kemiska analysmetoder bekräftar bara hur omfattande, korrekta och universella de är för användning i forskning.

Elektrokemiska metoder
Grunden för dessa metoder är reaktioner i vattenlösningar och på elektroder under påverkan av elektrisk ström, det vill säga förenklat elektrolys. Följaktligen är den typ av energi som används i dessa analysmetoder flödet av elektroner.
Dessa metoder har sin egen klassificering av fysikalisk-kemiska analysmetoder. Denna grupp inkluderar följande arter.
- Elektrisk gravimetrisk analys. Baserat på resultaten av elektrolysen avlägsnas en massa ämnen från elektroderna, som sedan vägs och analyseras. Så här erhålls data om massan av föreningar. En av varianterna av sådant arbete är metoden för intern elektrolys.
- Polarografi. Den bygger på att mäta strömstyrkan. Det är denna indikator som kommer att vara direkt proportionell mot koncentrationen av de önskade jonerna i lösningen. Amperometrisk titrering av lösningar är en variant av den övervägda polarografiska metoden.
- Coulometri bygger på Faradays lag. Mängden elektricitet som spenderas på processen mäts, från vilken de sedan fortsätter för att beräkna jonerna i lösningen.
- Potentiometri - baserad på mätning av elektrodpotentialerna hos deltagarna i processen.
Alla processer som beaktas är fysikaliska och kemiska metoder för kvantitativ analys av ämnen. Med hjälp av elektrokemiska forskningsmetoder separeras blandningar i sina beståndsdelar och mängden koppar, bly, nickel och andra metaller bestäms.

Spektral
Den är baserad på processerna för elektromagnetisk strålning. Det finns också en klassificering av de metoder som används.
- Flamfotometri. För att göra detta sprutas testämnet in i en öppen låga. Många metallkatjoner ger en viss färg, så deras identifiering är möjlig på detta sätt. Dessa är främst ämnen som: alkaliska och alkaliska jordartsmetaller, koppar, gallium, tallium, indium, mangan, bly och till och med fosfor.
- Absorptionsspektroskopi. Inkluderar två typer: spektrofotometri och kolorimetri. Grunden är bestämningen av det spektrum som absorberas av ämnet. Det verkar i både de synliga och heta (infraröda) delarna av strålningen.
- Turbidimetri.
- Nefelometri.
- Luminescensanalys.
- Refraktometri och polarometri.
Uppenbarligen är alla metoder som beaktas i denna grupp metoder för kvalitativ analys av ett ämne.
Emissionsanalys
Detta orsakar emission eller absorption av elektromagnetiska vågor. Baserat på denna indikator kan man bedöma den kvalitativa sammansättningen av ämnet, det vill säga vilka specifika element som ingår i sammansättningen av forskningsprovet.

Kromatografisk
Fysikalisk-kemiska studier utförs ofta i olika miljöer. I det här fallet är det mycket bekvämt och effektiva metoder bli kromatografisk. De är indelade i följande typer.
- Adsorptionsvätska. Det är baserat på komponenternas olika adsorptionsförmåga.
- Gaskromatografi. Även baserat på adsorptionskapacitet, endast för gaser och ämnen i ångtillstånd. Används vid massproduktion av föreningar i liknande aggregationstillstånd, när produkten kommer ut i en blandning som behöver separeras.
- Fördelningskromatografi.
- Redox.
- Jonbytare.
- Papper.
- Tunt lager.
- Sedimentär.
- Adsorption-komplexbildning.
Termisk
Fysikalisk-kemisk forskning innebär också användning av metoder baserade på värmen från bildning eller nedbrytning av ämnen. Sådana metoder har också sin egen klassificering.
- Termisk analys.
- Termogravimetri.
- Kalorimetri.
- Entalpometri.
- Dilatometri.
Alla dessa metoder gör det möjligt att bestämma mängden värme mekaniska egenskaper, entalpier av ämnen. Baserat på dessa indikatorer bestäms sammansättningen av föreningarna kvantitativt.
Metoder för analytisk kemi
Denna del av kemi har sina egna egenskaper, eftersom huvuduppgiften för analytiker är den kvalitativa bestämningen av ett ämnes sammansättning, deras identifiering och kvantitativa redovisning. I detta avseende är analytiska analysmetoder indelade i:
- kemisk;
- biologisk;
- fysikalisk-kemiska.
Eftersom vi är intresserade av det senare kommer vi att överväga vilka av dem som används för att bestämma ämnen.
Huvudtyperna av fysikalisk-kemiska metoder inom analytisk kemi
- Spektroskopisk - alla samma som de som diskuterats ovan.
- Massspektral - baserat på inverkan av elektriska och magnetiska fält på fria radikaler, partiklar eller joner. Fysikalisk-kemisk analys laboratorieassistenter ger den kombinerade effekten av de angivna kraftfälten, och partiklarna separeras i separata jonflöden baserat på förhållandet mellan laddning och massa.
- Radioaktiva metoder.
- Elektrokemisk.
- Biokemisk.
- Termisk.
Vad kan vi lära oss om ämnen och molekyler från sådana bearbetningsmetoder? För det första den isotopiska sammansättningen. Och även: reaktionsprodukter, innehållet av vissa partiklar i särskilt rena ämnen, massorna av de sökta föreningarna och annat användbart för vetenskapsmän.
Metoder för analytisk kemi är således viktiga sätt att få information om joner, partiklar, föreningar, ämnen och deras analys.
Den stora majoriteten av information om ämnen, deras egenskaper och kemiska omvandlingar erhölls genom kemiska eller fysikalisk-kemiska experiment. Därför bör den huvudsakliga metoden som används av kemister betraktas som ett kemiskt experiment.
Traditionerna för experimentell kemi har utvecklats under århundraden. Förr när det inte fanns någon kemi exakt vetenskap, i antiken och på medeltiden, upptäckte vetenskapsmän och hantverkare, ibland av en slump, och ibland målmedvetet, metoder för att erhålla och rena många ämnen som användes i ekonomisk verksamhet: metaller, syror, alkalier, färgämnen etc. Ansamlingen av sådan information underlättades i hög grad av alkemister (se Alkemi).
Tack vare detta, redan tidiga XIX V. kemister var väl bevandrade i grunderna för experimentell konst, särskilt metoderna för att rena alla typer av vätskor och fasta ämnen, vilket gjorde att de kunde åstadkomma mycket viktigaste upptäckterna. Och ändå började kemi att bli en vetenskap i ordets moderna mening, en exakt vetenskap, först på 1800-talet, när lagen om multipla förhållanden upptäcktes och atom-molekylär vetenskap utvecklades. Sedan den tiden började kemiska experiment att inkludera inte bara studier av omvandlingar av ämnen och metoder för deras isolering, utan också mätning av olika kvantitativa egenskaper.
Ett modernt kemiskt experiment innebär många olika mätningar. Både utrustningen för att genomföra experiment och kemiska glasvaror har förändrats. I ett modernt laboratorium hittar du inte hemgjorda retorter - de har ersatts av standardglasutrustning som tillverkats av industrin och anpassad specifikt för att utföra en viss kemisk procedur. Arbetsmetoder har också blivit standard, som i vår tid inte längre behöver uppfinnas på nytt av varje kemist. En beskrivning av de bästa av dem, bevisad av många års erfarenhet, finns i läroböcker och manualer.
Metoder för att studera materia har inte bara blivit mer universella, utan också mycket mer mångsidiga. Alla stor roll I arbetet med en kemist används fysikalisk och fysikalisk-kemiska forskningsmetoder, utformade för att isolera och rena föreningar, samt för att fastställa deras sammansättning och struktur.
Den klassiska tekniken att rena ämnen var extremt arbetsintensiv. Det finns fall där kemister tillbringade år av arbete med att isolera en enskild förening från en blandning. Således kunde salter av sällsynta jordartsmetaller isoleras i ren form först efter tusentals fraktionerade kristallisationer. Men även efter detta kunde renheten hos ämnet inte alltid garanteras.
Moderna kromatografimetoder gör det möjligt att snabbt separera ett ämne från föroreningar (preparativ kromatografi) och kontrollera dess kemiska identitet ( analytisk kromatografi). Dessutom används klassiska men mycket förbättrade metoder för destillation, extraktion och kristallisation, såväl som sådana effektiva moderna metoder som elektrofores, zonsmältning, etc. för att rena ämnen.
Uppgiften som ställs inför en syntetisk kemist efter att ha isolerat ett rent ämne - att fastställa dess molekylers sammansättning och struktur - relaterar till stor del till analytisk kemi. Med den traditionella arbetstekniken var det också mycket arbetskrävande. Nästan den enda mätmetoden som tidigare använts var elementaranalys, vilket gör att man kan fastställa den enklaste formeln för en förening.
För att bestämma den verkliga molekylära såväl som strukturformeln var det ofta nödvändigt att studera ett ämnes reaktioner med olika reagenser; isolera produkterna från dessa reaktioner i individuell form, vilket i sin tur etablerar deras struktur. Och så vidare - tills, baserat på dessa omvandlingar, strukturen hos den okända substansen blev uppenbar. Därför etablerar strukturformeln för ett komplex organisk förening tog ofta mycket tid, och arbete som slutade med motsyntes ansågs vara komplett - produktionen av ett nytt ämne i enlighet med formeln som fastställts för det.
Denna klassiska metod var extremt användbar för utvecklingen av kemi i allmänhet. Numera används den sällan. Som regel studeras en isolerad okänd substans, efter elementaranalys, med masspektrometri, spektral analys i det synliga, ultravioletta och infraröda området, såväl som kärnmagnetisk resonans. För en rimlig härledning av en strukturformel krävs användning av ett helt komplex av metoder, och deras data kompletterar vanligtvis varandra. Men i ett antal fall ger konventionella metoder inte ett entydigt resultat, och man måste tillgripa direkta metoder för att bestämma strukturen, till exempel röntgendiffraktionsanalys.
Fysikalisk-kemiska metoder används inte bara inom syntetisk kemi. De är inte mindre viktiga när man studerar kinetiken för kemiska reaktioner, såväl som deras mekanismer. Huvuduppgiften för varje experiment för att studera hastigheten för en reaktion är att noggrant mäta den tidsvarierande, och vanligtvis mycket lilla, koncentrationen av reaktanten. För att lösa detta problem, beroende på ämnets natur, kan du använda både kromatografiska metoder och olika typer spektralanalys och metoder för elektrokemi (se Analytisk kemi).
Teknikens perfektion har nått en så hög nivå att det har blivit möjligt att exakt bestämma hastigheten för till och med "momentana", som tidigare trott, reaktioner, till exempel bildandet av vattenmolekyler från vätekatjoner och anjoner. Med en initial koncentration av båda jonerna lika med 1 mol/l är tiden för denna reaktion flera hundra miljarddelar av en sekund.
Fysikalisk-kemiska forskningsmetoder är speciellt anpassade för detektering av kortlivade mellanliggande partiklar som bildas vid kemiska reaktioner. För att göra detta är enheterna utrustade med antingen höghastighetsinspelningsenheter eller tillbehör som säkerställer drift vid mycket låga temperaturer. Dessa metoder registrerar framgångsrikt spektra av partiklar vars livslängd under normala förhållanden mäts i tusendelar av en sekund, till exempel fria radikaler.
Förutom experimentella metoder används beräkningar i stor utsträckning inom modern kemi. Således gör den termodynamiska beräkningen av en reagerande blandning av ämnen det möjligt att exakt förutsäga dess jämviktssammansättning (se Kemisk jämvikt).
Beräkningar av molekyler baserade på kvantmekanik och kvantkemi har blivit allmänt accepterade och i många fall oumbärliga. Dessa metoder är baserade på en mycket komplex matematisk apparat och kräver användning av de mest avancerade elektroniska datorerna - datorer. De gör det möjligt att skapa modeller av den elektroniska strukturen hos molekyler som förklarar de observerbara, mätbara egenskaperna hos instabila molekyler eller mellanliggande partiklar som bildas under reaktioner.
Metoder för att studera ämnen som utvecklats av kemister och fysikaliska kemister är användbara inte bara inom kemi, utan också inom relaterade vetenskaper: fysik, biologi, geologi. Varken industri eller lantbruk, varken medicin eller kriminologi. Fysikalisk-kemiska instrument intar en hedersplats i rymdskepp, med vars hjälp det nära jordens rymden och närliggande planeter utforskas.
Därför är kunskap om grunderna i kemi nödvändig för varje person, oavsett hans yrke, och vidareutvecklingen av dess metoder är en av de viktigaste riktningarna för den vetenskapliga och tekniska revolutionen.
metabolism vitamin energi
När man studerar ämnesomsättningen spåras alla omvandlingar av ett ämne från den form i vilken det kommer in i kroppen till slutprodukter, utsöndras från kroppen. Metoder.
- - Användning av intakta djur eller organ. Djuret injiceras med föreningen som studeras, och sedan bestäms möjliga omvandlingsprodukter (metaboliter) av detta ämne i dess urin och exkrementer. Mer specifik information kan erhållas genom att studera metabolismen av ett specifikt organ, såsom levern eller hjärnan. I dessa fall injiceras ämnet i motsvarande blodkärl, och metaboliterna bestäms i blodet som strömmar från detta organ.
- - Användning av celler. Även celler är mycket komplexa organiserade system. De har en kärna, och i cytoplasman som omger den finns mindre kroppar, de så kallade. organeller av olika storlekar och konsistenser. Med hjälp av lämplig teknik kan vävnaden "homogeniseras" och sedan utsättas för differentiell centrifugering (separation) för att erhålla preparat som endast innehåller mitokondrier, endast mikrosomer eller en klar vätska - cytoplasman. Dessa läkemedel kan individuellt inkuberas med substansen vars metabolism studeras, och på så sätt är det möjligt att avgöra vilka subcellulära strukturer som är involverade i dess successiva transformationer.
- - Användning av radioaktiva isotoper. För att studera ett ämnes metabolism krävs följande: 1) lämpliga analysmetoder för att bestämma detta ämne och dess metaboliter; 2) metoder som gör det möjligt att skilja ett tillsatt ämne från samma ämne som redan finns i en given biologisk produkt. Dessa krav fungerade som ett stort hinder för studiet av metabolism fram till upptäckten av radioaktiva isotoper av grundämnen och, framför allt, radioaktivt kol 14 C. Med tillkomsten av föreningar "märkta" med 14 C, såväl som instrument för att mäta svag radioaktivitet , var dessa svårigheter övervunna. Om en 14C-märkt fettsyra tillsätts till ett biologiskt preparat, till exempel till en suspension av mitokondrier, krävs inga speciella analyser för att fastställa produkterna av dess omvandlingar; För att uppskatta graden av dess användning räcker det att helt enkelt mäta radioaktiviteten hos successivt erhållna mitokondriella fraktioner. Samma teknik gör det möjligt att enkelt särskilja radioaktiva fettsyramolekyler som introducerats av försöksledaren från fettsyramolekyler som redan fanns i mitokondrierna i början av experimentet.
- - Kromatografi och elektrofores. Det behövs också metoder för att separera blandningar som består av små mängder organiska ämnen. Den viktigaste av dem är kromatografi. Det är baserat på fenomenet adsorption. Separationen av komponenterna i blandningen utförs antingen på papper eller genom adsorption på en sorbent som fylls i kolonner (långa glasrör), följt av gradvis eluering (uttvättning) av varje komponent.
- - Isotopmetoder.
- 1. Radioaktivt jod. Det används för att utvärdera sköldkörtelfunktionen, visualisera sköldkörtelknölar och tumörer och visualisera sköldkörtelcancermetastaser. Dessutom används radioaktivt jod för att behandla tyreotoxikos och sköldkörtelcancer.
- 2. 99m Tc-perteknetat ( 99m TCO 4 -) fångas upp av sköldkörteln, men ingår inte i tyreoglobulin. Därför är det möjligt att erhålla med hjälp av 99m Tc-perteknetat bra bild sköldkörteln även hos patienter som får sköldkörtelhormoner. Eftersom 99m Tc-perteknetat inte är ett substrat för syntesen av sköldkörtelhormoner, scintigram erhållna med denna isotop och med 131 I-kolesterol (6-beta-metyl-[ 131 I]-norkolesterol) används för att upptäcka hyperplasi och tumörer i binjurebarken vid Cushings syndrom och primär hyperaldosteronism. För att upptäcka aldosteron kombineras scintigrafi med 131I-kolesterol med undertryckande av hypotalamus-hypofys-binjureaxeln med dexametason. Förbättrad ackumulering av isotopen i en binjure mot bakgrund av suppression indikerar aldosterom, medan symmetrisk ackumulering av isotopen snarare indikerar bilateral hyperplasi av binjurebarken.
- 3. Meta- 131 I-bensylguanidin eller meta- 123 I-bensylguanidin Används för att visualisera binjure- och extraadrenala feokromocytom, tumörer i nervkammen (paragangliom), karcinoider och medullär sköldkörtelcancer och dess metastaser.
- 4. Andra typer av scintigrafi. Benscintigrafi har framgångsrikt använts vid Pagets sjukdom för att lokalisera lesioner och bedöma sjukdomens svårighetsgrad.