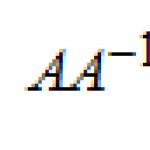По време на химични реакции от едно вещество се получават други вещества (да не се бъркат с ядрени реакции, при които един химичен елемент се превръща в друг).
Всяка химическа реакция се описва с химично уравнение:
Реагенти → Реакционни продукти
Стрелката показва посоката на реакцията.
Например:
При тази реакция метанът (CH4) реагира с кислород (O2), което води до образуването на въглероден диоксид (CO2) и вода (H2O), или по-скоро водна пара. Точно такава реакция се случва във вашата кухня, когато запалите газова горелка. Уравнението трябва да се чете така: една молекула газ метан реагира с две молекули газ кислород, което води до една молекула въглероден диоксид и две молекули вода (пара).
Наричат се числата пред компонентите на химична реакция коефициенти на реакция.
Химичните реакции са ендотермичен(с поглъщане на енергия) и екзотермичен(с освобождаване на енергия). Изгарянето на метан е типичен пример за екзотермична реакция.
Има няколко вида химични реакции. Най-често:
- комбинирани реакции;
- реакции на разлагане;
- реакции на единично заместване;
- реакции на двойно заместване;
- реакции на окисление;
- редокс реакции.
Реакции на свързване
При комбинирана реакция най-малко два елемента образуват един продукт:
2Na (t) + Cl 2 (g) → 2NaCl (t)- образуване на сол.
Трябва да се обърне внимание на съществен нюанс на реакциите на съединението: в зависимост от условията на реакцията или пропорциите на реагентите, участващи в реакцията, нейният резултат могат да бъдат различни продукти. Например, при нормални условия на изгаряне на въглища се получава въглероден диоксид:
C (t) + O 2 (g) → CO 2 (g)
Ако няма достатъчно кислород, тогава се образува смъртоносен въглероден окис:
2C (t) + O 2 (g) → 2CO (g)
Реакции на разлагане
Тези реакции са като че ли противоположни по същество на реакциите на съединението. В резултат на реакцията на разлагане веществото се разпада на два (3, 4...) по-прости елемента (съединения):
- 2H 2 O (g) → 2H 2 (g) + O 2 (g)- разлагане на вода
- 2H 2 O 2 (g) → 2H 2 (g) O + O 2 (g)- разлагане на водороден прекис
Единични реакции на заместване
В резултат на реакции на единично заместване, по-активният елемент замества по-малко активния елемент в съединението:
Zn (t) + CuSO 4 (разтвор) → ZnSO 4 (разтвор) + Cu (t)
Цинкът в разтвора на меден сулфат измества по-малко активната мед, което води до разтвор на цинков сулфат.
Степента на активност на металите във възходящ ред на активност:
- Най-активни са алкалните и алкалоземните метали.
Йонното уравнение за горната реакция ще бъде:
Zn (t) + Cu 2+ + SO 4 2- → Zn 2+ + SO 4 2- + Cu (t)
Йонната връзка CuSO 4, когато се разтваря във вода, се разлага на меден катион (заряд 2+) и анион сулфат (заряд 2-). В резултат на реакцията на заместване се образува цинков катион (който има същия заряд като медния катион: 2-). Имайте предвид, че сулфатният анион присъства и от двете страни на уравнението, тоест по всички правила на математиката може да бъде намален. Резултатът е йонно-молекулярно уравнение:
Zn (t) + Cu 2+ → Zn 2+ + Cu (t)
Реакции на двойно заместване
При реакциите на двойно заместване два електрона вече са заменени. Такива реакции също се наричат обменни реакции. Тези реакции протичат в разтвор, за да образуват:
- неразтворимо твърдо вещество (реакция на утаяване);
- вода (реакции на неутрализиране).
Реакции на утаяване
При смесване на разтвор на сребърен нитрат (сол) с разтвор на натриев хлорид се образува сребърен хлорид:
Молекулно уравнение: KCl (разтвор) + AgNO 3 (p-p) → AgCl (t) + KNO 3 (p-p)
йонно уравнение: K + + Cl - + Ag + + NO 3 - → AgCl (t) + K + + NO 3 -
Молекулно-йонно уравнение: Cl - + Ag + → AgCl (t)
Ако съединението е разтворимо, то ще бъде в разтвор в йонна форма. Ако съединението е неразтворимо, то ще се утаи, образувайки твърдо вещество.
Реакции на неутрализиране
Това са реакции между киселини и основи, в резултат на които се образуват водни молекули.
Например, реакцията на смесване на разтвор на сярна киселина и разтвор на натриев хидроксид (луга):
Молекулно уравнение: H 2 SO 4 (p-p) + 2NaOH (p-p) → Na2SO4 (p-p) + 2H2O (l)
йонно уравнение: 2H + + SO 4 2- + 2Na + + 2OH - → 2Na + + SO 4 2- + 2H 2 O (l)
Молекулно-йонно уравнение: 2H + + 2OH - → 2H 2 O (g) или H + + OH - → H 2 O (g)
Реакции на окисляване
Това са реакции на взаимодействие на вещества с газообразен кислород във въздуха, при които като правило се отделя голямо количество енергия под формата на топлина и светлина. Типична реакция на окисление е горенето. В самото начало на тази страница е дадена реакцията на взаимодействието на метан с кислород:
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
Метанът се отнася до въглеводороди (съединения на въглерод и водород). Когато въглеводородът реагира с кислорода, се отделя много топлинна енергия.
Редокс реакции
Това са реакции, при които се обменят електрони между атомите на реагентите. Реакциите, обсъдени по-горе, също са редокс реакции:
- 2Na + Cl 2 → 2NaCl - съединение реакция
- CH 4 + 2O 2 → CO 2 + 2H 2 O - реакция на окисление
- Zn + CuSO 4 → ZnSO 4 + Cu - реакция на единично заместване
Най-подробните редокс реакции с голям брой примери за решаване на уравнения по метода на електронния баланс и метода на полуреакция са описани в раздела




1. Посочете правилното определение на сложна реакция: А. Реакцията на образуване на няколко вещества от едно просто вещество; Б. Реакция, при която едно сложно вещество се образува от няколко прости или сложни вещества. Б. Реакция, при която веществата обменят своите съставки.

2. Посочете правилното определение на реакция на заместване: А. Реакция между основа и киселина; Б. Реакцията на взаимодействието на две прости вещества; В. Реакция между вещества, при която атомите на простото вещество заместват атомите на един от елементите в сложно вещество.

3. Посочете правилното определение за реакция на разлагане: А. Реакция, при която от едно сложно вещество се образуват няколко прости или сложни вещества; Б. Реакция, при която веществата обменят своите съставки; Б. Реакция с образуване на кислородни и водородни молекули.


5. Какъв тип реакции е взаимодействието на киселинни оксиди с основни оксиди: 5. Какъв тип реакции е взаимодействието на киселинни оксиди с основни оксиди: А. Обменна реакция; Б. Реакция на свързване; Б. Реакция на разлагане; D. Реакция на заместване.


7. Веществата, чиито формули са KNO 3 FeCl 2, Na 2 SO 4 се наричат: 7. Веществата, чиито формули са KNO 3 FeCl 2, Na 2 SO 4 се наричат: А) соли; Б) основания; Б) киселини Г) оксиди. А) соли Б) основания; Б) киселини Г) оксиди. 8. Веществата, чиито формули са HNO 3, HCl, H 2 SO 4 се наричат: 8. Веществата, чиито формули са HNO 3, HCl, H 2 SO 4 се наричат: А) соли; Б) киселини; Б) основания Г) оксиди. А) соли Б) киселини; Б) основания Г) оксиди. 9. Веществата, чиито формули са KOH, Fe(OH) 2, NaOH се наричат: 9. Веществата, чиито формули са KOH, Fe(OH) 2, NaOH се наричат: А) соли; Б) киселини; Б) основания Г) оксиди. 10. Веществата, чиито формули са NO 2, Fe 2 O 3, Na 2 O се наричат: А) соли; Б) киселини; Б) основания Г) оксиди. 10. Веществата, чиито формули са NO 2, Fe 2 O 3, Na 2 O се наричат: А) соли; Б) киселини; Б) основания Г) оксиди. А) соли Б) киселини; Б) основания Г) оксиди. 11. Посочете алкални метали: 11. Посочете алкални метали: Cu, Fe, Na, K, Zn, Li. Cu, Fe, Na, K, Zn, Li.


„Физика Термонуклеарни реакции“ – Термоядрена реакция. Проблем: Плазмата е трудна за задържане. Контролирана термоядрена реакция е енергийно благоприятна реакция. Подробности за реакцията. Презентация по физика на тема: При звездите протичат самоподдържащи се термоядрени реакции. Какво е термоядрена реакция? TOKAMAK (тороидална магнитна камера с ток).
„Видове химични реакции“ – Всички реакции са придружени от термични ефекти. Обратими реакции - химични реакции, протичащи едновременно в две противоположни посоки (напред и назад) Например: 3H2 + N2? 2NH3 Лабораторна работа. Как да назовем процеса, който се осъществява? Възникват химични реакции: при смесване или физически контакт на реагентите, спонтанно при нагряване с участието на катализатори, действието на светлина, електрически ток, механичен ефект и др.
"Класификация на реакциите" - Ендотермични реакции: P (червено)<=>R (бял). S (ромбично)<=>S (пластмаса). Класификация на реакциите. Повечето от тези реакции са. Разлагане на калиев перманганат при нагряване: Реакция на горене на литий: Алотропия на фосфора: Реакция на горене на калций във въздуха: Интересни реакции.
"Ядрени реакции" - Радиоактивното излъчване има пагубен ефект върху живите клетки. Ядрените реакции са придружени от енергийни трансформации. биологично действие. Биологичен ефект на радиоактивното лъчение. Ефектът на радиацията върху хората. термоядрени реакции. Приложение на ядрени реакции. Ядрен реактор.
"Реакции на киселини" - BaCL2 + H2SO4 = BaSO4 + 2HCL Ba2+ + SO42- = BaSO4. Киселини. Отговори. Класификация на киселините. Проверете себе си. Обобщение. Типични реакции на киселини.
1. Кои реакции се наричат обменни реакции? Как се различават те от реакциите на комбиниране, разлагане и заместване?
Обменните реакции са реакции, при които две сложни вещества обменят съставните си части. Така от сложни вещества се образуват сложни вещества. Докато при реакциите на разлагане от едно сложно вещество се образуват няколко прости или сложни вещества, при сложните реакции едно сложно вещество се образува от няколко прости или сложни вещества, при реакциите на заместване едно сложно и едно просто вещество се образува от едно просто и едно сложно вещество.
2. Може ли да се твърди, че взаимодействието на карбонатен разтвор на който и да е метал и киселина е само обменна реакция? Защо?
3. Напишете уравненията за обменните реакции между разтворите:
а) калциев хлорид и натриев фосфат;
б) сярна киселина и железен (III) хидроксид. 
4. Коя от обменните реакции, чиито схеми 
ще работи до края? За да отговорите, използвайте таблицата за разтворимост на хидроксиди и соли във вода. 
5. Определете количеството вещество натриев хидроксид, което ще е необходимо за пълно неутрализиране на 980 g 30% разтвор на фосфорна киселина. 
6. Изчислете количеството на веществото и масата на утайката, образувана при взаимодействието на 980 g 20% разтвор на меден (II) сулфат с необходимото количество калиев хидроксид.