সুগন্ধি হাইড্রোকার্বন
সুগন্ধি যৌগ জন্য বা অ্যারেনেস, যৌগগুলির একটি বৃহৎ গোষ্ঠীকে বোঝায় যার অণুগুলিতে বিশেষ ভৌত এবং রাসায়নিক বৈশিষ্ট্য সহ একটি স্থিতিশীল চক্রীয় গ্রুপ (বেনজিন রিং) থাকে।
এই যৌগগুলির মধ্যে প্রাথমিকভাবে বেনজিন এবং এর অসংখ্য ডেরিভেটিভ অন্তর্ভুক্ত রয়েছে।
"সুগন্ধযুক্ত" শব্দটি মূলত প্রাকৃতিক উত্সের পণ্যগুলির সাথে সম্পর্কিত, যার একটি সুগন্ধযুক্ত গন্ধ ছিল। যেহেতু এই যৌগগুলির মধ্যে বেনজিন রিং অন্তর্ভুক্ত অনেকগুলি ছিল, তাই "সুগন্ধি" শব্দটি বেনজিন রিংযুক্ত যে কোনও যৌগ (অপ্রীতিকর গন্ধ সহ) প্রযোজ্য হতে শুরু করে।
বেনজিন, এর ইলেকট্রনিক গঠন
বেনজিন সূত্র C 6 H 6 অনুসারে, এটি অনুমান করা যেতে পারে যে বেনজিন একটি অত্যন্ত অসম্পৃক্ত যৌগ, যেমন, অ্যাসিটিলিনের অনুরূপ। যাইহোক, বেনজিনের রাসায়নিক বৈশিষ্ট্য এই অনুমানকে সমর্থন করে না। সুতরাং, স্বাভাবিক অবস্থায়, বেনজিন অসম্পৃক্ত হাইড্রোকার্বনের বৈশিষ্ট্যযুক্ত প্রতিক্রিয়া দেয় না: এটি হাইড্রোজেন হ্যালাইডের সাথে অতিরিক্ত বিক্রিয়ায় প্রবেশ করে না, এটি পটাসিয়াম পারম্যাঙ্গনেটের দ্রবণকে বিবর্ণ করে না। একই সময়ে, বেনজিন স্যাচুরেটেড হাইড্রোকার্বনের মতো প্রতিস্থাপন বিক্রিয়ায় প্রবেশ করে।
এই তথ্যগুলি নির্দেশ করে যে বেনজিন আংশিকভাবে স্যাচুরেটেডের মতো, আংশিকভাবে অসম্পৃক্ত হাইড্রোকার্বনের সাথে এবং একই সময়ে উভয়ের থেকে আলাদা। অতএব, দীর্ঘকাল ধরে, বেনজিনের গঠন প্রশ্নে বিজ্ঞানীদের মধ্যে প্রাণবন্ত আলোচনা চলছিল।
60 এর দশকে। গত শতাব্দীর, বেশিরভাগ রসায়নবিদ বেনজিনের চক্রাকার কাঠামোর তত্ত্বটি এই সত্যের ভিত্তিতে গ্রহণ করেছিলেন যে মনো-প্রতিস্থাপিত বেনজিন ডেরিভেটিভের (উদাহরণস্বরূপ, ব্রোমোবেনজিন) আইসোমার নেই।
বেনজিনের সবচেয়ে স্বীকৃত সূত্র, 1865 সালে জার্মান রসায়নবিদ কেকুলের দ্বারা প্রস্তাবিত, যাতে বেনজিন কার্বন পরমাণুর রিংয়ে দ্বৈত বন্ধন সরলগুলির সাথে বিকল্প হয় এবং কেকুলের অনুমান অনুসারে, সরল এবং দ্বৈত বন্ধন ক্রমাগত চলে:
যাইহোক, কেকুলে সূত্র ব্যাখ্যা করতে পারে না কেন বেনজিন অসম্পৃক্ত যৌগের বৈশিষ্ট্য প্রদর্শন করে না।
আধুনিক ধারণা অনুসারে, বেনজিন অণুর গঠন একটি সমতল ষড়ভুজের মতো, যার বাহুগুলি একে অপরের সমান এবং 0.140 nm। এই দূরত্বটি 0.154 এনএম (একক বন্ডের দৈর্ঘ্য) এবং 0.134 এনএম (ডবল বন্ডের দৈর্ঘ্য) এর মধ্যে গড়ে। শুধু কার্বন পরমাণুই নয়, তাদের সাথে যুক্ত ছয়টি হাইড্রোজেন পরমাণুও একই সমতলে অবস্থান করে। H - C - C এবং C - C - C বন্ধন দ্বারা গঠিত কোণগুলি 120 °।

বেনজিনের কার্বন পরমাণুগুলি sp 2 সংকরকরণে রয়েছে, অর্থাৎ কার্বন পরমাণুর চারটি অরবিটালের মধ্যে মাত্র তিনটিই সংকরিত (একটি 2s- এবং দুটি 2p-), যা কার্বন পরমাণুর মধ্যে σ-বন্ধন গঠনে অংশ নেয়। চতুর্থ 2 পি-অরবিটাল দুটি প্রতিবেশী কার্বন পরমাণুর (ডান এবং বাম) 2টি পি-অরবিটালের সাথে ওভারল্যাপ করে, ডাম্বেল-আকৃতির অরবিটালে অবস্থিত ছয়টি ডিলোকালাইজড π-ইলেক্ট্রন, যার অক্ষগুলি বেনজিন বলয়ের সমতলে লম্ব হয়ে থাকে। একটি একক স্থিতিশীল বন্ধ ইলেকট্রনিক সিস্টেম।
সমস্ত ছয়টি কার্বন পরমাণু দ্বারা একটি বন্ধ ইলেকট্রনিক সিস্টেম গঠনের ফলে, একক এবং দ্বিগুণ বন্ধনের "সারিবদ্ধতা" ঘটে, যেমন বেনজিন অণুতে কোন ক্লাসিক্যাল ডাবল এবং একক বন্ধন নেই। সমস্ত কার্বন পরমাণুর মধ্যে π-ইলেকট্রন ঘনত্বের অভিন্ন বন্টনই বেনজিন অণুর উচ্চ স্থিতিশীলতার কারণ। বেনজিন অণুতে π-ইলেকট্রন ঘনত্বের অভিন্নতার উপর জোর দিতে, একজন নিম্নলিখিত সূত্রটি অবলম্বন করে:

বেনজিন সিরিজের অ্যারোমেটিক হাইড্রোকার্বনের নামকরণ এবং আইসোমেরিজম
বেনজিন C n H 2 n -6 এর সমজাতীয় সিরিজের সাধারণ সূত্র।
বেনজিনের প্রথম হোমোলগ হল মিথাইলবেনজিন, বা টলুইনগ 7 জ 8

অন্য সব মনো-অবস্থাপিত ডেরিভেটিভের মতো আইসোমারের কোনো অবস্থান নেই।
দ্বিতীয় হোমোলগ সি 8 এইচ 10 চারটি আইসোমেরিক আকারে বিদ্যমান থাকতে পারে: ইথিলবেনজিন সি 6 এইচ 5 -সি 2 এইচ 5 এবং তিনটি ডাইমিথাইলবেনজেন, বা জাইলিন, C b H 4 (CH 3) 2 (অর্থো-, মেটা-এবং জোড়া-জাইলিনস, বা 1,2-, 1,3- এবং 1,4-ডাইমিথাইলবেনজেনস):

বেনজিন C 6 H 5 এর র্যাডিক্যাল (অবশিষ্ট) - বলা হয় ফিনাইল; বেনজিন হোমোলগগুলির র্যাডিকালগুলির নামগুলি মূলে প্রত্যয় যোগ করে সংশ্লিষ্ট হাইড্রোকার্বনগুলির নাম থেকে নেওয়া হয়েছে - পলি(tolyl, xylyl, ইত্যাদি) এবং অক্ষর (o-, মি-, পি-)বা পাশের চেইনের অবস্থান অঙ্ক করে। সাধারণ নামসব সুগন্ধি র্যাডিকাল জন্য অ্যারিলসশিরোনামের অনুরূপ অ্যালকাইলসঅ্যালকেন র্যাডিকেলের জন্য। র্যাডিকাল C 6 H 5 -CH 2 - বলা হয় বেনজিল
আরও জটিল বেনজিন ডেরিভেটিভের নামকরণ করার সময়, সম্ভাব্য সংখ্যার ক্রম থেকে, একটি বেছে নেওয়া হয় যেখানে বিকল্প সংখ্যাগুলির অঙ্কগুলির যোগফল সবচেয়ে ছোট হবে। উদাহরণস্বরূপ, কাঠামোর ডাইমিথাইল ইথাইল বেনজিন

1,4-ডাইমিথাইল-2-ইথাইলবেনজিন (অঙ্কের যোগফল 7) বলা উচিত, 1,4-ডাইমিথাইল-6-ইথিলবেনজিন নয় (অঙ্কগুলির যোগফল 11)।
বেনজিনের উচ্চতর হোমোলগগুলির নামগুলি প্রায়শই সুগন্ধযুক্ত নিউক্লিয়াসের নাম থেকে নেওয়া হয় না, তবে পার্শ্ব শৃঙ্খলের নাম থেকে, অর্থাৎ, এগুলিকে অ্যালকেনের ডেরিভেটিভ হিসাবে বিবেচনা করা হয়:

বেনজিন সিরিজের সুগন্ধযুক্ত হাইড্রোকার্বনের ভৌত বৈশিষ্ট্য
বেনজিন হোমোলগাস সিরিজের নীচের সদস্যগুলি একটি বৈশিষ্ট্যযুক্ত গন্ধযুক্ত বর্ণহীন তরল। তাদের ঘনত্ব এবং প্রতিসরণ সূচক অ্যালকেন এবং অ্যালকেনগুলির তুলনায় অনেক বেশি। গলনাঙ্কও লক্ষণীয়ভাবে বেশি। উচ্চ কার্বন সামগ্রীর কারণে, সমস্ত সুগন্ধযুক্ত যৌগগুলি খুব ধোঁয়াটে শিখায় জ্বলতে থাকে। সমস্ত সুগন্ধযুক্ত হাইড্রোকার্বন জলে অদ্রবণীয় এবং বেশিরভাগ জৈব দ্রাবকগুলিতে অত্যন্ত দ্রবণীয়: তাদের মধ্যে অনেকগুলি সহজেই বাষ্প পাতনযোগ্য।
বেনজিন সিরিজের সুগন্ধযুক্ত হাইড্রোকার্বনের রাসায়নিক বৈশিষ্ট্য
সুগন্ধযুক্ত হাইড্রোকার্বনগুলির জন্য, সবচেয়ে সাধারণ প্রতিক্রিয়া হল সুগন্ধযুক্ত রিংয়ে হাইড্রোজেনের প্রতিস্থাপন। সুগন্ধযুক্ত হাইড্রোকার্বনগুলি কঠোর পরিস্থিতিতে খুব অসুবিধা সহ অতিরিক্ত বিক্রিয়ায় প্রবেশ করে। বেনজিনের একটি স্বতন্ত্র বৈশিষ্ট্য হল এর অক্সিডাইজিং এজেন্টদের উল্লেখযোগ্য প্রতিরোধ।
সংযোজন প্রতিক্রিয়া
হাইড্রোজেন সংযোজন
কিছু বিরল ক্ষেত্রে, বেনজিন অতিরিক্ত প্রতিক্রিয়া করতে সক্ষম। হাইড্রোজেনেশন, অর্থাৎ, হাইড্রোজেনের সংযোজন, অনুঘটকের (Ni, Pt, Pd) উপস্থিতিতে কঠোর পরিস্থিতিতে হাইড্রোজেনের ক্রিয়ায় ঘটে। এই ক্ষেত্রে, একটি বেনজিন অণু তিনটি হাইড্রোজেন অণু যোগ করে সাইক্লোহেক্সেন গঠন করে:

হ্যালোজেন সংযোজন
যদি বেনজিনে ক্লোরিনের একটি দ্রবণ সূর্যালোক বা অতিবেগুনি রশ্মির সংস্পর্শে আসে, তবে তিনটি হ্যালোজেন অণু আমূলভাবে যুক্ত হয়ে হেক্সাক্লোরোসাইক্লোহেক্সেন-এর স্টেরিওআইসোমারগুলির একটি জটিল মিশ্রণ তৈরি করে:

হেক্সাক্লোরোসাইক্লোহেক্সাই (বাণিজ্য নাম হেক্সাক্লোরান) বর্তমানে একটি কীটনাশক হিসাবে ব্যবহৃত হয় - পদার্থ যা কীটপতঙ্গ ধ্বংস করে যা কৃষির কীটপতঙ্গ।
জারণ প্রতিক্রিয়া
বেনজিন স্যাচুরেটেড হাইড্রোকার্বনের চেয়ে অক্সিডাইজিং এজেন্টের জন্য আরও বেশি প্রতিরোধী। এটি পাতলা নাইট্রিক অ্যাসিড, KMnO 4 দ্রবণ, ইত্যাদি দ্বারা জারিত হয় না। বেনজিন হোমোলগগুলি আরও সহজে জারিত হয়। কিন্তু এমনকি তাদের মধ্যে, বেনজিন কোর এটির সাথে যুক্ত হাইড্রোকার্বন র্যাডিকেলের তুলনায় অক্সিডাইজিং এজেন্টের ক্রিয়াকলাপের তুলনায় তুলনামূলকভাবে বেশি প্রতিরোধী। একটি নিয়ম আছে: যেকোন বেনজিন হোমোলগ একপাশে চেইন সহ একটি মনোবাসিক (বেনজোইক) অ্যাসিডে জারিত হয়:
যেকোন জটিলতার একাধিক পার্শ্ব চেইন সহ বেনজিন হোমোলগগুলি পলিব্যাসিক অ্যারোমেটিক অ্যাসিড গঠনের জন্য জারিত হয়:

প্রতিস্থাপন প্রতিক্রিয়া
1. হ্যালোজেনেশন
স্বাভাবিক অবস্থায়, সুগন্ধযুক্ত হাইড্রোকার্বন কার্যত হ্যালোজেনের সাথে প্রতিক্রিয়া করে না; বেনজিন ব্রোমিনের পানিকে বিবর্ণ করে না, তবে অনুঘটকের উপস্থিতিতে (FeCl 3, FeBr 3, AlCl 3) একটি নির্জল মাধ্যমে, ক্লোরিন এবং ব্রোমিন ঘরের তাপমাত্রায় বেনজিনের সাথে জোরালোভাবে বিক্রিয়া করে:

নাইট্রেশন প্রতিক্রিয়া
প্রতিক্রিয়ার জন্য, ঘনীভূত নাইট্রিক অ্যাসিড ব্যবহার করা হয়, প্রায়শই ঘনীভূত সালফিউরিক অ্যাসিড (অনুঘটক) এর সাথে মিশ্রিত হয়:

অপরিবর্তিত বেনজিনে, প্রতিস্থাপন বিক্রিয়ায় সমস্ত ছয়টি কার্বন পরমাণুর প্রতিক্রিয়া একই; বিকল্প কোন কার্বন পরমাণুর সাথে সংযুক্ত করতে পারে। যদি বেনজিন নিউক্লিয়াসে ইতিমধ্যে একটি প্রতিস্থাপক থাকে, তবে এর প্রভাবে নিউক্লিয়াসের অবস্থা পরিবর্তিত হয় এবং যে অবস্থানে কোন নতুন প্রতিস্থাপক প্রবেশ করে তা নির্ভর করে প্রথম বিকল্পের প্রকৃতির উপর। এটি থেকে এটি অনুসরণ করা হয় যে বেনজিন নিউক্লিয়াসের প্রতিটি বিকল্প একটি নির্দিষ্ট নির্দেশক (অভিমুখী) প্রভাব প্রদর্শন করে এবং শুধুমাত্র নিজের সাথে সম্পর্কিত কিছু অবস্থানে নতুন বিকল্পের প্রবর্তনে অবদান রাখে।
নির্দেশক প্রভাব অনুসারে, বিভিন্ন বিকল্প দুটি গ্রুপে বিভক্ত:
ক) প্রথম ধরণের বিকল্প:
তারা যেকোনো নতুন প্রতিস্থাপককে অর্থো এবং প্যারা পজিশনে নিজেদের সম্মানের সাথে নির্দেশ করে। একই সময়ে, তাদের প্রায় সকলেই সুগন্ধযুক্ত গোষ্ঠীর স্থায়িত্ব হ্রাস করে এবং বেনজিন রিংয়ের প্রতিস্থাপন প্রতিক্রিয়া এবং প্রতিক্রিয়া উভয়কেই সহজতর করে:

খ) দ্বিতীয় ধরণের বিকল্প:
তারা নিজেদের সম্পর্কে একটি মেটা অবস্থানে কোনো নতুন বিকল্প নির্দেশ. তারা সুগন্ধি গোষ্ঠীর স্থায়িত্ব বাড়ায় এবং প্রতিস্থাপন প্রতিক্রিয়াকে বাধা দেয়:

এইভাবে, বেনজিনের (এবং অন্যান্য অ্যারেনেস) সুগন্ধযুক্ত প্রকৃতি প্রকাশ করা হয় যে এই যৌগটি, গঠনে অসম্পৃক্ত হওয়ায়, বেশ কয়েকটি রাসায়নিক বিক্রিয়ায় নিজেকে একটি সীমাবদ্ধ যৌগ হিসাবে প্রকাশ করে, এটি রাসায়নিক স্থিতিশীলতা, সংযোজন অসুবিধা দ্বারা চিহ্নিত করা হয়। প্রতিক্রিয়া শুধুমাত্র বিশেষ অবস্থার অধীনে (অনুঘটক, বিকিরণ) বেনজিন এমন আচরণ করে যেন তার অণুতে তিনটি দ্বৈত বন্ধন রয়েছে।
বেনজিন একটি অসম্পৃক্ত যৌগ, তবে আমরা খুঁজে পেয়েছি যে এর গঠনে কোনও দ্বিগুণ বন্ধন নেই, তবে একটি সুগন্ধযুক্ত বন্ধন - একটি ডিলোকালাইজড ইলেক্ট্রন মেঘ। অসম্পৃক্ত হাইড্রোকার্বনের সাধারণ প্রতিক্রিয়া - ইলেক্ট্রোফিলিক সংযোজন এবং অক্সিডেশন - বেনজিনের জন্য সাধারণ নয়। সুতরাং, এটি ব্রোমিনের জলকে বিবর্ণ করে না, ওয়াগনার প্রতিক্রিয়া দেয় না (ঘরের তাপমাত্রায় পটাসিয়াম পারম্যাঙ্গনেটের দ্রবণ দিয়ে জারণ)। বেনজিন এমন প্রতিক্রিয়া দ্বারা চিহ্নিত করা হয় যা বন্ধ সংযোজিত সিস্টেমের ব্যাঘাত ঘটায় না - প্রতিস্থাপন প্রতিক্রিয়া। বেনজিনের বৈশিষ্ট্য কী ধরনের প্রতিস্থাপন (র্যাডিকাল, ইলেক্ট্রোফিলিক, নিউক্লিওফিলিক) তা খুঁজে বের করতে, এর বৈদ্যুতিন কাঠামো মনে রাখবেন: অণুর σ-কঙ্কাল সমতল, এবং একটি সুগন্ধযুক্ত মেঘ সমতলের উপরে এবং নীচে অবস্থিত। এই সুগন্ধযুক্ত মেঘের সাথে যোগাযোগ করতে, বিকারকটি অবশ্যই ইলেক্ট্রোফিলিক হতে হবে। সুতরাং, বেনজিনের জন্য (এবং সাধারণভাবে সুগন্ধযুক্ত যৌগ) ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়া . S E প্রতিক্রিয়াগুলির উদাহরণ হল:
প্রথম পর্যায়ে, ইলেক্ট্রোফাইল বেনজিন অণুর কাছে আসে এবং সম্পূর্ণ সুগন্ধযুক্ত মেঘের সাথে যোগাযোগ করে (তারা একে অপরের প্রতি আকৃষ্ট হয়)। গঠিত π-জটিল. একটি নতুন গঠনের জন্য সমযোজী বন্ধনএকটি কার্বন-ইলেক্ট্রোফাইলের একজোড়া ইলেকট্রন প্রয়োজন। ইলেক্ট্রোফাইল এটি সুগন্ধযুক্ত মেঘ থেকে বের করে, গঠন করে σ-জটিল. এটি একটি বন্ধ কনজুগেট সিস্টেম নয়, কারণ কার্বন পরমাণু যেটি একটি নতুন σ-বন্ধন তৈরি করেছিল তা sp 3 সংকরায়নে চলে যায় (এটি সমতলের বাইরে চলে যায় এবং আর একটি অ-সংকর pz অরবিটাল থাকে না)। অবশিষ্ট পাঁচটি কার্বন পরমাণু সংযোজনে অংশগ্রহণ করতে থাকে, একটি সাধারণ ইলেকট্রন মেঘ তৈরি করে যাতে চারটি ইলেকট্রন ডিলোকালাইজ করা হয় (6-2=4), তাই σ-জটিলে ধনাত্মক চার্জ একটি নির্দিষ্ট কার্বন পরমাণুর উপর নির্দেশিত হয় না, কিন্তু খোলা রিং কেন্দ্র. সুতরাং, σ-জটিল একটি সুগন্ধযুক্ত গঠন নয়। সুগন্ধি পুনরুদ্ধার করার জন্য, এটিকে একটি হাইড্রোজেন প্রোটন (H +) বিভক্ত করতে হবে। এটি প্রতিক্রিয়া মাধ্যমের অবশিষ্ট নিউক্লিওফাইল (Nu -) দ্বারা নেওয়া হয়। দুটি ইলেকট্রন C-H বন্ডসুগন্ধি মেঘে ফিরে যান, আবার কার্বন পরমাণু হয়ে যায়
sp 2 -সংকর এবং সংযোজনে অংশগ্রহণ করতে পারে।
ইলেক্ট্রোফিলিক প্রতিস্থাপন বিক্রিয়ার হার-সীমিত পর্যায় হল σ-জটিল গঠনের পর্যায়, যেহেতু এই ক্ষেত্রে, সুগন্ধি হ্রাস ঘটে, যার জন্য শক্তি ব্যয় প্রয়োজন।
বেনজিনে ইলেক্ট্রোফিলিক প্রতিস্থাপনের বিভিন্ন প্রতিক্রিয়া একটি সাধারণ প্রক্রিয়া অনুসারে এগিয়ে যায় এবং শুধুমাত্র একটি ইলেক্ট্রোফিলিক কণা গঠনের পর্যায়ে ভিন্ন হয়।
নাইট্রেশন প্রতিক্রিয়াবেনজিন ঘনীভূত নাইট্রিক এবং সালফিউরিক অ্যাসিডের মিশ্রণের ক্রিয়ায় এগিয়ে যায় (উপরের প্রতিক্রিয়া স্কিমটি দেখুন)। এর প্রক্রিয়া বিবেচনা করা যাক।
 |
প্রতিক্রিয়ার প্রথম পর্যায়ে, নাইট্রিক অ্যাসিড সালফিউরিক অ্যাসিডের সাথে মিথস্ক্রিয়া করে। এই ক্ষেত্রে, নাইট্রিক অ্যাসিড একটি বেস হিসাবে কাজ করে, একটি সালফিউরিক অ্যাসিড অণু থেকে একটি প্রোটন গ্রহণ করে (ব্রনস্টেডের তত্ত্ব অনুসারে, একটি অ্যাসিড একটি অণু বা আয়ন যা একটি প্রোটন দান করে এবং একটি বেস একটি অণু বা আয়ন যা একটি হাইড্রোজেন প্রোটন গ্রহণ করে। ) প্রোটোনেটেড নাইট্রিক অ্যাসিড গঠিত হয়, যা জলের অণুকে বিভক্ত করে, নাইট্রোনিয়াম ক্যাটেশন বা নাইট্রোনিয়াম ক্যাটেশনে পরিণত হয়। এটি ইলেক্ট্রোফিলিক কণা। এইভাবে, সালফিউরিক অ্যাসিড একটি অনুঘটক হিসাবে কাজ করে, একটি ইলেক্ট্রোফিলিক বিকারক গঠনে অংশ নেয়। সালফিউরিক অ্যাসিডের দ্বিতীয় ভূমিকা হল একটি ডিওয়াটারিং এজেন্টের ভূমিকা। ভারসাম্যকে ডানদিকে সরানোর জন্য প্রতিক্রিয়া গোলক থেকে জলকে অপসারণ করতে হবে।
একটি ইলেক্ট্রোফাইল গঠনের পর - একটি নাইট্রোনিয়াম ক্যাটেশন - প্রতিক্রিয়াটি একটি সাধারণ প্রক্রিয়া অনুসারে এগিয়ে যায়, π- এবং
σ-জটিল:
দয়া করে মনে রাখবেন: σ-জটিলকে নাইট্রোবেনজিনে রূপান্তরের পর্যায়ে (সুগন্ধি পুনরুদ্ধারের পর্যায়), একটি হাইড্রোজেন প্রোটন সালফিউরিক অ্যাসিডের অ্যানিয়নের ক্রিয়ায় বিভক্ত হয়, যখন সালফিউরিক অ্যাসিড আবার তৈরি হয়, যা প্রমাণ করে যে এটা এই প্রতিক্রিয়া জন্য অনুঘটক ছিল.
 প্রভাবক হ্যালোজেনেশন প্রতিক্রিয়াতথাকথিত লুইস অ্যাসিড (লুইস তত্ত্ব অনুসারে, অ্যাসিড হল নিরপেক্ষ অণু বা আয়ন যা একজোড়া ইলেকট্রন গ্রহণ করতে পারে): FeCl 3, FeBr 3, AlCl 3, AlBr 3, ইত্যাদি। হ্যালোজেন অণুকে পোলারাইজ করার জন্য একটি অনুঘটকের প্রয়োজন। লুইস অ্যাসিড ক্লোরিনের একক ইলেক্ট্রন জোড়াকে নিজের মধ্যে স্থানচ্যুত করে, একটি জটিল গঠন করে যেখানে একটি আংশিক ধনাত্মক চার্জ ক্লোরিন পরমাণুর একটিতে কেন্দ্রীভূত হয়:
প্রভাবক হ্যালোজেনেশন প্রতিক্রিয়াতথাকথিত লুইস অ্যাসিড (লুইস তত্ত্ব অনুসারে, অ্যাসিড হল নিরপেক্ষ অণু বা আয়ন যা একজোড়া ইলেকট্রন গ্রহণ করতে পারে): FeCl 3, FeBr 3, AlCl 3, AlBr 3, ইত্যাদি। হ্যালোজেন অণুকে পোলারাইজ করার জন্য একটি অনুঘটকের প্রয়োজন। লুইস অ্যাসিড ক্লোরিনের একক ইলেক্ট্রন জোড়াকে নিজের মধ্যে স্থানচ্যুত করে, একটি জটিল গঠন করে যেখানে একটি আংশিক ধনাত্মক চার্জ ক্লোরিন পরমাণুর একটিতে কেন্দ্রীভূত হয়:
π-জটিল গঠনের পর্যায়ে, Cl-Cl বন্ধনের আরও মেরুকরণ ঘটে এবং এটি ভিন্নতাগতভাবে ভেঙে যায় এবং Cl + অবিলম্বে σ-জটিল গঠনে অংশগ্রহণ করে।
 একইভাবে এগিয়ে যান অ্যালকিলেশন প্রতিক্রিয়া(ফ্রিডেল-কারুশিল্প প্রতিক্রিয়া)।
একইভাবে এগিয়ে যান অ্যালকিলেশন প্রতিক্রিয়া(ফ্রিডেল-কারুশিল্প প্রতিক্রিয়া)।
 |
মিথাইল ক্লোরাইডের C-Cl বন্ধন হেটেরোলিটিক্যালি ভাঙার জন্য যথেষ্ট পোলার নয়। একটি লুইস অ্যাসিডের ক্রিয়ায়, কার্বন পরমাণুর আংশিক ধনাত্মক চার্জ বৃদ্ধি পায় এবং বিকারক-অনুঘটক কমপ্লেক্সটি শুরু হওয়া মিথাইল ক্লোরাইডের চেয়ে শক্তিশালী ইলেক্ট্রোফাইল।
সালফোনেশন প্রতিক্রিয়াবেনজিন ওলিয়ামের ক্রিয়ায় এগিয়ে যায় (ঘন সালফিউরিক অ্যাসিডে সালফিউরিক অ্যানহাইড্রাইড SO 3 এর দ্রবণ)।
সালফার পরমাণুর উপর বড় আংশিক ইতিবাচক চার্জের কারণে সালফিউরিক অ্যানহাইড্রাইড অণু একটি ইলেক্ট্রোফাইল।
 |
যখন একটি π-জটিল গঠিত হয়, তখন S=O বন্ধন (প্রথমত, π-বন্ধন) মেরুকরণ হয় এবং হেটেরোলিটিক পদ্ধতিতে ভেঙ্গে যায়, তাই, যখন একটি σ-জটিল গঠিত হয়, তখন অক্সিজেনের উপর মোট ঋণাত্মক চার্জ উপস্থিত হয় পরমাণু সুগন্ধি পুনরুদ্ধার করার জন্য, একটি হাইড্রোজেন প্রোটন রিংয়ের কার্বন পরমাণু থেকে বিভক্ত হয় এবং ঋণাত্মক চার্জযুক্ত অক্সিজেনে চলে যায়। বেনজেনেসালফোনিক অ্যাসিড তৈরি হয়।
যখন আমরা বেনজিনে ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়া বিবেচনা করি, তখন প্রতিক্রিয়াটি কোন অবস্থানে ঘটে সেই প্রশ্নের সম্মুখীন হই না, কারণ সমস্ত কার্বন পরমাণু একেবারে সমান। আরেকটি বিষয় হল যদি বেনজিন রিং এর একটি বিকল্প থাকে। এই ক্ষেত্রে, ইলেক্ট্রোফিলিক প্রতিস্থাপনের ফলস্বরূপ, তিনটি আইসোমার গঠন মৌলিকভাবে সম্ভব:
 |
এই সম্ভাব্য পণ্যগুলির মধ্যে কোনটি প্রধান এই প্রশ্নের উত্তর দেওয়ার জন্য, বিকল্পটির বৈদ্যুতিন প্রভাবগুলি বিবেচনা করা প্রয়োজন।
আসুন বেনজিন এবং এর ডেরিভেটিভগুলিতে ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়াগুলি থেকে সরে আসি এবং সাধারণভাবে ইলেকট্রনিক প্রভাবগুলি বিবেচনা করি।
জৈব অণুতে পরমাণুর পারস্পরিক প্রভাব
সংযোগ ইলেকট্রনিক প্রভাব
জৈব যৌগের অণুতে পরমাণু এবং পারমাণবিক গোষ্ঠী একে অপরকে প্রভাবিত করে, এবং শুধুমাত্র পরমাণুই নয়, সরাসরি আবদ্ধ বন্ধুবন্ধুর সঙ্গে. এই প্রভাব কোনো না কোনোভাবে অণুর মাধ্যমে সঞ্চারিত হয়। বন্ডের মেরুকরণের কারণে অণুতে পরমাণুর প্রভাবের স্থানান্তরকে ইলেকট্রনিক প্রভাব বলা হয় . দুটি ধরণের ইলেকট্রনিক প্রভাব রয়েছে: প্রবর্তক এবং মেসোমেরিক প্রভাব।
প্রস্তাবনামূলক প্রভাব- এটি তাদের মেরুকরণের কারণে σ-বন্ডের চেইন বরাবর প্রতিস্থাপকদের প্রভাবের স্থানান্তর। প্রবর্তক প্রভাবকে I চিহ্ন দ্বারা চিহ্নিত করা হয়। 1-ক্লোরোবুটেনের উদাহরণ ব্যবহার করে বিবেচনা করুন:
ক্লোরিনের উচ্চতর বৈদ্যুতিক ঋণাত্মকতার কারণে C-Cl বন্ধন মেরু। কার্বন পরমাণুর উপর একটি আংশিক ধনাত্মক চার্জ (δ+) উৎপন্ন হয়। পরবর্তী σ-বন্ধনের ইলেকট্রন জোড়া ইলেকট্রন-ঘাটতি কার্বন পরমাণুর দিকে স্থানান্তরিত হয়, অর্থাৎ পোলারাইজড এই কারণে, পরবর্তী কার্বন পরমাণুর উপরও একটি আংশিক ধনাত্মক চার্জ (δ + ') দেখা দেয়। তাই ক্লোরিন প্ররোচিত করেমেরুকরণ শুধুমাত্র "নিজের" σ-বন্ডের নয়, শৃঙ্খলে পরবর্তীগুলিরও। অনুগ্রহ করে মনে রাখবেন যে প্রতিটি পরবর্তী আংশিক ধনাত্মক চার্জ আগেরটির চেয়ে কম (δ+>δ+’>δ+’>δ+’’), অর্থাৎ প্রবর্তক প্রভাব স্যাঁতসেঁতে সার্কিটের মাধ্যমে প্রেরণ করা হয়। এটি σ বন্ডের নিম্ন মেরুকরণযোগ্যতা দ্বারা ব্যাখ্যা করা যেতে পারে। এটি সাধারণত গৃহীত হয় যে প্রবর্তক প্রভাব 3-4 σ-বন্ড পর্যন্ত প্রসারিত হয়। প্রদত্ত উদাহরণে, ক্লোরিন পরমাণু বন্ড চেইন বরাবর ইলেক্ট্রনের ঘনত্বকে স্থানান্তরিত করে স্বয়ং নিজেকে. এই ধরনের প্রভাবকে নেতিবাচক প্রবর্তক প্রভাব বলা হয় এবং -I Cl দ্বারা চিহ্নিত করা হয়।
বেশিরভাগ বিকল্প একটি নেতিবাচক প্রবর্তক প্রভাব প্রদর্শন করে, যেহেতু তাদের গঠনে এমন পরমাণু রয়েছে যা হাইড্রোজেনের চেয়ে বেশি তড়িৎ ঋণাত্মক (হাইড্রোজেনের প্রবর্তক প্রভাব শূন্য বলে ধরে নেওয়া হয়)। যেমন: -F, -Cl, -Br, -I, -OH, -NH 2, -NO 2,
-COOH, >C=O।
 |  |
||
যদি বিকল্পটি σ-বন্ডের চেইন বরাবর ইলেকট্রন ঘনত্বকে স্থানান্তরিত করে ধাক্কা, এটি একটি ইতিবাচক প্রবর্তক প্রভাব (+I) প্রদর্শন করে। উদাহরণ স্বরূপ:

মোট নেতিবাচক চার্জ সহ অক্সিজেন একটি ইতিবাচক প্রবর্তক প্রভাব প্রদর্শন করে।
![]()
প্রোপেন অণুতে, মিথাইল গ্রুপের কার্বন হয় sp 3 -হাইব্রিডাইজড, এবং ডাবল বন্ডের কার্বন পরমাণু sp 2 -হাইব্রিডাইজড হয়, অর্থাৎ আরো ইলেক্ট্রোনেগেটিভ। অতএব, মিথাইল গ্রুপ ইলেক্ট্রন ঘনত্বকে নিজের থেকে দূরে সরিয়ে দেয়, একটি ইতিবাচক প্রবর্তক প্রভাব (+I CH 3) দেখায়।
সুতরাং, প্রবর্তক প্রভাব নিজেকে যে কোনো অণুতে প্রকাশ করতে পারে যেখানে বিভিন্ন ইলেক্ট্রোনেগেটিভিটির পরমাণু রয়েছে।
মেসোমেরিক প্রভাব- এটি π বন্ধনের মেরুকরণের মাধ্যমে সংযোজিত সিস্টেমে বিকল্পগুলির বৈদ্যুতিন প্রভাবের স্থানান্তর। মেসোমেরিক প্রভাব ক্ষয় ছাড়াই প্রেরণ করা হয়, কারণ π বন্ধনগুলি সহজেই মেরুকরণ করা হয়। অনুগ্রহ করে নোট করুন: শুধুমাত্র সেইসব প্রতিস্থাপক যেগুলি নিজেদের সংযোজিত সিস্টেমের অংশ, তাদের একটি মেসোমেরিক প্রভাব রয়েছে। উদাহরণ স্বরূপ:
মেসোমেরিক প্রভাব ইতিবাচক (+M) এবং ঋণাত্মক (-M) উভয়ই হতে পারে।
ভিনাইল ক্লোরাইড অণুতে, ভাগ না করা ইলেক্ট্রন জোড়া ক্লোরিন p, π-সংযোজনে অংশগ্রহণ করে, অর্থাৎ সংযোজিত সিস্টেমে ক্লোরিনের অবদান প্রতিটি কার্বন পরমাণুর চেয়ে বেশি। অতএব, ক্লোরিন একটি ইতিবাচক মেসোমেরিক প্রভাব প্রদর্শন করে।
 অ্যাক্রিলিক অ্যালডিহাইড অণু
অ্যাক্রিলিক অ্যালডিহাইড অণু
π.π- কনজুগেট সিস্টেম। অক্সিজেন পরমাণু সংযোজনে একটি ইলেকট্রন দান করে - প্রতিটি কার্বন পরমাণুর সমান সংখ্যা, কিন্তু অক্সিজেনের বৈদ্যুতিন ঋণাত্মকতা কার্বনের চেয়ে বেশি, তাই অক্সিজেন সংযোজিত সিস্টেমের ইলেকট্রন ঘনত্বকে নিজের দিকে সরিয়ে নেয়, অ্যালডিহাইড গ্রুপটি সম্পূর্ণরূপে একটি প্রদর্শন করে। নেতিবাচক মেসোমেরিক প্রভাব।
সুতরাং, সংযোজনে দুটি ইলেকট্রন দানকারী বিকল্পগুলির একটি ইতিবাচক মেসোমেরিক প্রভাব রয়েছে। এর মধ্যে রয়েছে:
ক) মোট ঋণাত্মক চার্জ সহ বিকল্প, উদাহরণস্বরূপ, –O - ;
খ) বিকল্প, যার গঠনে pz অরবিটালে শেয়ার না করা ইলেকট্রন জোড়া সহ পরমাণু রয়েছে, উদাহরণস্বরূপ: -NH 2, -OH,
-F, -Cl, -Br-, -I, -OR (-OCH 3 , -OC 2 H 5)।
সংযোজিত সিস্টেমে ইলেক্ট্রনের ঘনত্বকে নিজেদের মধ্যে স্থানান্তরিত করে এমন বিকল্পগুলি একটি নেতিবাচক মেসোমেরিক প্রভাব প্রদর্শন করে। এর মধ্যে গঠনের বিকল্প অন্তর্ভুক্ত রয়েছে যার ডবল বন্ড রয়েছে, উদাহরণস্বরূপ:
 |
একটি প্রতিস্থাপক একই সাথে প্রবর্তক এবং মেসোমেরিক প্রভাব উভয়ই প্রদর্শন করতে পারে। কিছু ক্ষেত্রে, এই প্রভাবগুলির দিক একই (উদাহরণস্বরূপ, -I এবং -M), অন্যগুলিতে তারা বিপরীত দিকে কাজ করে (উদাহরণস্বরূপ, -I এবং +M)। এই ক্ষেত্রে কীভাবে বাকী অণুর উপর প্রতিস্থাপনের সামগ্রিক প্রভাব নির্ধারণ করা যায় (অন্য কথায়, প্রদত্ত বিকল্পটি একটি ইলেকট্রন দাতা বা একটি ইলেকট্রন গ্রহণকারী কিনা তা কীভাবে নির্ধারণ করা যায়)? অণুর অবশিষ্ট অংশে ইলেকট্রনের ঘনত্ব বাড়ায় এমন প্রতিবস্থাপককে ইলেকট্রন-দানকারী বিকল্প বলা হয় এবং অণুর অবশিষ্ট অংশে ইলেকট্রনের ঘনত্ব হ্রাসকারী বিকল্পগুলিকে ইলেকট্রন-প্রত্যাহারকারী বিকল্প বলা হয়।
একটি বিকল্পের সামগ্রিক প্রভাব নির্ধারণ করার জন্য, এটির বৈদ্যুতিন প্রভাবগুলি মাত্রায় তুলনা করা প্রয়োজন। যদি ইতিবাচক সাইন প্রভাব বিরাজ করে, তাহলে প্রতিস্থাপক হল একটি ইলেক্ট্রন দাতা। যদি নেতিবাচক প্রভাব বিরাজ করে, তাহলে বিকল্পটি একটি ইলেকট্রন-প্রত্যাহারকারী বিকল্প। এটি লক্ষ করা উচিত যে, একটি নিয়ম হিসাবে, মেসোমেরিক প্রভাবটি আবেশী প্রভাবের চেয়ে শক্তিশালী (π বন্ধনের মেরুকরণের বৃহত্তর ক্ষমতার কারণে)। যাইহোক, এই নিয়মের ব্যতিক্রম রয়েছে: হ্যালোজেনের প্রবর্তক প্রভাব মেসোমেরিকের চেয়ে শক্তিশালী।
বিবেচনা কংক্রিট উদাহরণ:
এই যৌগটিতে, অ্যামিনো গ্রুপটি একটি ইলেকট্রন-দানকারী বিকল্প, কারণ এর ইতিবাচক মেসোমেরিক প্রভাব নেতিবাচক প্রবর্তক প্রভাবের চেয়ে বেশি স্পষ্ট।
 এই যৌগটিতে, অ্যামিনো গ্রুপটি একটি ইলেকট্রন-প্রত্যাহারকারী বিকল্প, কারণ শুধুমাত্র একটি নেতিবাচক প্রবর্তক প্রভাব প্রদর্শন করে।
এই যৌগটিতে, অ্যামিনো গ্রুপটি একটি ইলেকট্রন-প্রত্যাহারকারী বিকল্প, কারণ শুধুমাত্র একটি নেতিবাচক প্রবর্তক প্রভাব প্রদর্শন করে।
ফেনল অণুতে, হাইড্রক্সিল গ্রুপ হল একটি ইলেকট্রন-দানকারী বিকল্প যা নেতিবাচক প্রবর্তক একের উপর ইতিবাচক মেসোমেরিক প্রভাবের প্রাধান্যের কারণে।
 বেনজিল অ্যালকোহল অণুতে, হাইড্রক্সিল গ্রুপ সংযোজনে অংশগ্রহণ করে না এবং শুধুমাত্র একটি নেতিবাচক প্রবর্তক প্রভাব প্রদর্শন করে। অতএব, এটি একটি ইলেকট্রন-প্রত্যাহারকারী বিকল্প।
বেনজিল অ্যালকোহল অণুতে, হাইড্রক্সিল গ্রুপ সংযোজনে অংশগ্রহণ করে না এবং শুধুমাত্র একটি নেতিবাচক প্রবর্তক প্রভাব প্রদর্শন করে। অতএব, এটি একটি ইলেকট্রন-প্রত্যাহারকারী বিকল্প।
এই উদাহরণগুলি দেখায় যে কেউ সাধারণভাবে কোনও বিকল্পের প্রভাব বিবেচনা করতে পারে না, তবে একটি নির্দিষ্ট অণুতে এর প্রভাব বিবেচনা করতে হবে।
 শুধুমাত্র হ্যালোজেন সবসময় ইলেকট্রন-প্রত্যাহারকারী বিকল্প, কারণ তাদের নেতিবাচক প্রবর্তক প্রভাব ইতিবাচক মেসোমেরিকের চেয়ে শক্তিশালী। উদাহরণ স্বরূপ:
শুধুমাত্র হ্যালোজেন সবসময় ইলেকট্রন-প্রত্যাহারকারী বিকল্প, কারণ তাদের নেতিবাচক প্রবর্তক প্রভাব ইতিবাচক মেসোমেরিকের চেয়ে শক্তিশালী। উদাহরণ স্বরূপ:

এখন আসুন বেনজিন ডেরিভেটিভগুলিতে ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়াগুলিতে ফিরে আসা যাক। সুতরাং, আমরা খুঁজে পেয়েছি যে রিংটিতে ইতিমধ্যে উপস্থিত প্রতিস্থাপন ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়াগুলির কোর্সকে প্রভাবিত করে। এই প্রভাব কি?
বিকল্পটি S E বিক্রিয়ার হার এবং রিংয়ে প্রবর্তিত দ্বিতীয় বিকল্পের অবস্থানকে প্রভাবিত করে. আসুন প্রভাবের এই উভয় দিক বিবেচনা করি।
প্রতিক্রিয়া হারের উপর প্রভাব. রিংয়ে ইলেকট্রনের ঘনত্ব যত বেশি হবে, ইলেক্ট্রোফিলিক প্রতিস্থাপন বিক্রিয়া তত সহজ হবে। এটা স্পষ্ট যে ইলেক্ট্রন-দানকারী বিকল্পগুলি S E প্রতিক্রিয়াগুলিকে সহজ করে (তারা চক্র সক্রিয়কারী), এবং ইলেকট্রন-প্রত্যাহারকারী বিকল্পগুলি তাদের বাধা দেয় (তারা চক্রটিকে নিষ্ক্রিয় করে)। অতএব, ইলেকট্রন-প্রত্যাহারকারী বিকল্প ধারণকারী বেনজিন ডেরিভেটিভগুলিতে ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়াগুলি আরও গুরুতর পরিস্থিতিতে সঞ্চালিত হয়।
 আসুন নাইট্রেশন বিক্রিয়ায় ফেনল, টলুইন, বেনজিন, ক্লোরোবেনজিন এবং নাইট্রোবেনজিনের কার্যকলাপের তুলনা করি।
আসুন নাইট্রেশন বিক্রিয়ায় ফেনল, টলুইন, বেনজিন, ক্লোরোবেনজিন এবং নাইট্রোবেনজিনের কার্যকলাপের তুলনা করি।
যেহেতু ফেনল এবং টলুইনে ইলেকট্রন-দানকারী উপাদান রয়েছে, তাই তারা বেনজিনের তুলনায় S E বিক্রিয়ায় বেশি সক্রিয়। বিপরীতে, ক্লোরোবেনজিন এবং নাইট্রোবেনজিন বেনজিনের তুলনায় এই প্রতিক্রিয়াগুলিতে কম সক্রিয়, কারণ ইলেকট্রন-প্রত্যাহারকারী বিকল্প রয়েছে। ওএইচ গ্রুপের ইতিবাচক মেসোমেরিক প্রভাবের কারণে ফেনল টলুইনের চেয়ে বেশি সক্রিয়। ক্লোরিন নাইট্রো গ্রুপের মতো শক্তিশালী ইলেকট্রন-প্রত্যাহারকারী বিকল্প নয়, কারণ নাইট্রো গ্রুপ নেতিবাচক প্রবর্তক এবং নেতিবাচক মেসোমেরিক প্রভাব উভয়ই প্রদর্শন করে। সুতরাং, এই সিরিজে, ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়াগুলির কার্যকলাপ ফেনল থেকে নাইট্রোবেনজিনে হ্রাস পায়। এটি পরীক্ষামূলকভাবে প্রতিষ্ঠিত হয়েছে যে যদি বেনজিন নাইট্রেশন বিক্রিয়ার হার 1 হিসাবে ধরা হয়, তবে এই সিরিজটি দেখতে এইরকম হবে:
ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়ার সময় সুগন্ধযুক্ত রিংয়ে প্রতিস্থাপনের প্রভাবের দ্বিতীয় দিকটি তথাকথিত বিকল্পের অভিমুখী ক্রিয়া. সমস্ত বিকল্পকে দুটি গ্রুপে ভাগ করা যেতে পারে: অর্থো-, প্যারা-ওরিয়েন্ট্যান্ট (1ম ধরণের বিকল্প) এবং মেটা-ওরিয়েন্ট্যান্ট (2য় ধরণের বিকল্প)।
প্রতি 1ম ধরনের বিকল্পঅন্তর্ভুক্ত: -OH, -O - , -NH 2 , অ্যালকাইল গ্রুপ (-CH 3 , -C 2 H 5 ইত্যাদি) এবং হ্যালোজেন। আপনি দেখতে পাচ্ছেন যে এই সমস্ত বিকল্প একটি ইতিবাচক প্রবর্তক প্রভাব এবং/অথবা একটি ইতিবাচক মেসোমেরিক প্রভাব প্রদর্শন করে। হ্যালোজেন ব্যতীত তাদের সকলেই রিংয়ে বিশেষ করে অর্থো এবং প্যারা অবস্থানে ইলেক্ট্রনের ঘনত্ব বৃদ্ধি করে। অতএব, ইলেক্ট্রোফাইলটি এই অবস্থানগুলিতে নির্দেশিত হয়। আসুন একটি উদাহরণ হিসাবে ফেনল নেওয়া যাক:
হাইড্রক্সিল গ্রুপের ইতিবাচক মেসোমেরিক প্রভাবের কারণে, ইলেক্ট্রন ঘনত্ব সংযোজিত সিস্টেমের সাথে পুনরায় বিতরণ করা হয় এবং অর্থো এবং প্যারা অবস্থানে এটি বিশেষভাবে বৃদ্ধি পায়।
 যখন ফেনল ব্রোমিনেট করা হয়, তখন অর্থো- এবং প্যারা-ব্রোমোফেনলের মিশ্রণ তৈরি হয়:
যখন ফেনল ব্রোমিনেট করা হয়, তখন অর্থো- এবং প্যারা-ব্রোমোফেনলের মিশ্রণ তৈরি হয়:
যদি ব্রোমিনেশন একটি পোলার দ্রাবক (ব্রোমিনের জল) মধ্যে বাহিত হয় এবং অতিরিক্ত ব্রোমিন ব্যবহার করা হয়, প্রতিক্রিয়াটি অবিলম্বে তিনটি অবস্থানে এগিয়ে যায়:
 |
২য় প্রকারের বিকল্পহল: -NH 3 + , -COOH, -CHO (অ্যালডিহাইড গ্রুপ), -NO 2 , -SO 3 H. এই সমস্ত বিকল্পগুলি সুগন্ধযুক্ত বলয়ে ইলেকট্রনের ঘনত্ব কমিয়ে দেয়, কিন্তু মেটা অবস্থানে এটির পুনঃবণ্টনের কারণে এটি কম হয় এত দৃঢ়ভাবে নয়, যেমন অর্থো- এবং প্যারা-তে। বেনজোয়িক অ্যাসিডের উদাহরণ ব্যবহার করে এটি বিবেচনা করুন:
কার্বক্সিল গ্রুপ নেতিবাচক প্রবর্তক এবং নেতিবাচক মেসোমেরিক প্রভাব প্রদর্শন করে। মেটা পজিশনে কনজুগেটেড সিস্টেম বরাবর পুনঃবন্টনের কারণে, ইলেকট্রনের ঘনত্ব অর্থো এবং প্যারা পজিশনের তুলনায় বেশি থাকে, তাই ইলেক্ট্রোফাইল মেটা পজিশনে আক্রমণ করবে:
 |
বেনজিনের চক্রাকার গঠন প্রথম F.A দ্বারা প্রস্তাবিত হয়েছিল। কেকুলে 1865 সালে

ফ্রেডরিখ অগাস্ট কেকুলে ভন স্ট্রাডোনিৎস ছিলেন 19 শতকের একজন অসামান্য জার্মান রসায়নবিদ। 1854 সালে তিনি প্রথম আবিষ্কার করেন জৈব যৌগসালফার ধারণকারী - থায়োএসেটিক অ্যাসিড (থিওইথানোইক অ্যাসিড)। উপরন্তু, তিনি ডায়াজো যৌগের গঠন স্থাপন করেন। যাইহোক, রসায়নের বিকাশে তার সবচেয়ে বিখ্যাত অবদান হল বেনজিনের গঠন (1866) প্রতিষ্ঠা। কেকুলে দেখিয়েছিলেন যে রিংয়ের চারপাশে বিকল্প বেনজিনের ডবল বন্ড (এই ধারণাটি তার কাছে প্রথম স্বপ্নে এসেছিল)। তিনি পরে দেখিয়েছিলেন যে দুটি সম্ভাব্য ডাবল বন্ড বিন্যাস অভিন্ন এবং বেনজিন রিং দুটি কাঠামোর মধ্যে একটি সংকর। এইভাবে, তিনি অনুরণন (মেসোমেরিজম) ধারণাটি অনুমান করেছিলেন, যা 1930 এর দশকের প্রথম দিকে রাসায়নিক বন্ধনের তত্ত্বে আবির্ভূত হয়েছিল।
যদি বেনজিনের সত্যিই এমন একটি কাঠামো থাকে, তাহলে এর 1,2-বিবর্তিত ডেরিভেটিভের প্রতিটিতে দুটি আইসোমার থাকা উচিত। উদাহরণ স্বরূপ,

যাইহোক, 1,2-বিবর্তিত বেনজিনের কেউই দুটি আইসোমারকে বিচ্ছিন্ন করতে পারে না।
অতএব, কেকুল পরবর্তীকালে পরামর্শ দিয়েছিলেন যে বেনজিন অণু দুটি কাঠামোর মধ্যে দ্রুত একে অপরের মধ্যে প্রবেশ করে বিদ্যমান:

উল্লেখ্য যে বেনজিন অণু এবং তাদের ডেরিভেটিভের এই ধরনের পরিকল্পিত উপস্থাপনা সাধারণত বেনজিন রিংয়ের কার্বন পরমাণুর সাথে সংযুক্ত হাইড্রোজেন পরমাণুকে নির্দেশ করে না।
আধুনিক রসায়নে, বেনজিন অণুকে এই দুটি সীমাবদ্ধ অনুরণিত ফর্মের একটি অনুরণিত সংকর হিসাবে বিবেচনা করা হয় (বিভাগ 2.1 দেখুন)। বেনজিন অণুর আরেকটি বর্ণনা তার আণবিক কক্ষপথের বিবেচনার উপর ভিত্তি করে। সেকেন্ডে। 3.1, এটি নির্দেশিত হয়েছিল যে -বন্ডিং অরবিটালে অবস্থিত -ইলেক্ট্রনগুলি বেনজিন বলয়ের সমস্ত কার্বন পরমাণুর মধ্যে স্থানান্তরিত হয় এবং একটি -ইলেক্ট্রন মেঘ তৈরি করে। এই উপস্থাপনা অনুসারে, বেনজিন অণুকে প্রচলিতভাবে নিম্নরূপ চিত্রিত করা যেতে পারে:
পরীক্ষামূলক তথ্য বেনজিনে ঠিক এই ধরনের কাঠামোর উপস্থিতি নিশ্চিত করে। যদি বেনজিনের কাঠামো থাকে যা কেকুলে মূলত প্রস্তাব করেছিলেন, তিনটি সংযোজিত ডাবল বন্ড সহ, তাহলে বেনজিনকে অ্যালকেনের মতো প্রতিক্রিয়া করতে হবে। যাইহোক, উপরে উল্লিখিত হিসাবে, বেনজিন অতিরিক্ত বিক্রিয়ায় প্রবেশ করে না। উপরন্তু, বেনজিন যদি তিনটি বিচ্ছিন্ন ডাবল বন্ড থাকে তার চেয়ে বেশি স্থিতিশীল। সেকেন্ডে। 5.3 এটি নির্দেশিত হয়েছিল যে সাইক্লোহেক্সেন গঠনের সাথে বেনজিনের হাইড্রোজেনেশনের এনথালপি একটি বড় নেতিবাচক
টেবিল 18.3। বিভিন্ন কার্বন-কার্বন বন্ডের দৈর্ঘ্য


ভাত। 18.6। বেনজিন অণুর জ্যামিতিক গঠন।
সাইক্লোহেক্সিনের হাইড্রোজেনেশনের এনথালপির তিনগুণ বেশি। এই মানের মধ্যে পার্থক্যকে সাধারণত ডেলোকালাইজেশন এনথালপি, রেজোন্যান্ট এনার্জি বা বেনজিন স্ট্যাবিলাইজেশন এনার্জি বলা হয়।
বেনজিন বলয়ের সমস্ত কার্বন-কার্বন বন্ধনের দৈর্ঘ্য একই, যা দৈর্ঘ্যের চেয়ে কম সি-সি সংযোগঅ্যালকেনসে, কিন্তু অ্যালকেনসে C \u003d C বন্ডের দৈর্ঘ্যের চেয়ে বেশি (সারণী 18.3)। এটি নিশ্চিত করে যে বেনজিনের কার্বন-কার্বন বন্ধনগুলি একক এবং দ্বিগুণ বন্ধনের মধ্যে একটি সংকর।
বেনজিন অণুর একটি সমতল গঠন রয়েছে, যা চিত্রে দেখানো হয়েছে। 18.6।
শারীরিক বৈশিষ্ট্য
স্বাভাবিক অবস্থায়, বেনজিন একটি বর্ণহীন তরল যা 5.5 ডিগ্রি সেলসিয়াসে জমাট বাঁধে এবং 80 ডিগ্রি সেলসিয়াসে ফুটতে থাকে। এটির একটি বৈশিষ্ট্যযুক্ত মনোরম গন্ধ রয়েছে, তবে উপরে উল্লিখিত হিসাবে এটি অত্যন্ত বিষাক্ত। বেনজিন পানির সাথে অপরিবর্তনীয়, এবং বেনজিন সিস্টেমে, পানি দুটি স্তরের শীর্ষে গঠন করে। যাইহোক, এটি অ-পোলার জৈব দ্রাবকগুলিতে দ্রবণীয় এবং অন্যান্য জৈব যৌগের জন্য এটি নিজেই একটি ভাল দ্রাবক।
রাসায়নিক বৈশিষ্ট্য
যদিও বেনজিন কিছু সংযোজন বিক্রিয়ায় প্রবেশ করে (নীচে দেখুন), এটি তাদের মধ্যে অ্যালকিনের সাধারণ প্রতিক্রিয়া প্রদর্শন করে না। উদাহরণস্বরূপ, এটি ব্রোমিন জল বা α-আয়ন দ্রবণকে বিবর্ণ করে না। উপরন্তু, বেনজিন
হাইড্রোক্লোরিক বা সালফিউরিক অ্যাসিডের মতো শক্তিশালী অ্যাসিডের সাথে অতিরিক্ত বিক্রিয়ায় প্রবেশ করে।
একই সময়ে, বেনজিন বেশ কয়েকটি ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়ায় অংশ নেয়। সুগন্ধযুক্ত যৌগগুলি এই ধরণের প্রতিক্রিয়াগুলির পণ্য, যেহেতু বেনজিনের ডিলোকালাইজড -ইলেক্ট্রন সিস্টেম এই প্রতিক্রিয়াগুলিতে সংরক্ষিত থাকে। কিছু ইলেক্ট্রোফাইল দ্বারা একটি বেনজিন রিংয়ে একটি হাইড্রোজেন পরমাণুর প্রতিস্থাপনের সাধারণ প্রক্রিয়া সেকেন্ডে বর্ণিত হয়েছে। 17.3। বেনজিনের ইলেক্ট্রোফিলিক প্রতিস্থাপনের উদাহরণ হল এর নাইট্রেশন, হ্যালোজেনেশন, সালফোনেশন এবং ফ্রিডেল-ক্র্যাফ্ট বিক্রিয়া।
নাইট্রেশন। ঘনীভূত নাইট্রিক এবং সালফিউরিক অ্যাসিডের মিশ্রণের সাথে চিকিত্সা করে বেনজিনকে নাইট্রেট করা যেতে পারে (এতে একটি গোষ্ঠীর প্রবর্তন)

নাইট্রোবেনজিন
এই প্রতিক্রিয়ার শর্ত এবং এর প্রক্রিয়া সেকেন্ডে বর্ণিত হয়েছে। 17.3।
নাইট্রোবেনজিন হল একটি ফ্যাকাশে হলুদ তরল যার একটি বৈশিষ্ট্যযুক্ত বাদামের গন্ধ। বেনজিনের নাইট্রেশনের সময়, নাইট্রোবেনজিন ছাড়াও, 1,3-ডাইনিট্রোবেনজিনের স্ফটিকও গঠিত হয়, যা নিম্নলিখিত প্রতিক্রিয়ার পণ্য:

হ্যালোজেনেশন। ক্লোরিন বা ব্রোমিনের সাথে অন্ধকারে বেনজিন মেশালে ক্যান্সার হবে না। যাইহোক, লুইস অ্যাসিডের বৈশিষ্ট্য সহ অনুঘটকের উপস্থিতিতে, এই জাতীয় মিশ্রণগুলিতে ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়া ঘটে। এই প্রতিক্রিয়াগুলির জন্য সাধারণ অনুঘটক হল আয়রন(III) ব্রোমাইড এবং অ্যালুমিনিয়াম ক্লোরাইড। এই অনুঘটকগুলির ক্রিয়া হল যে তারা হ্যালোজেন অণুতে মেরুকরণ তৈরি করে, যা পরে অনুঘটকের সাথে একটি জটিল গঠন করে:
যদিও কোন প্রত্যক্ষ প্রমাণ নেই যে এই ক্ষেত্রে মুক্ত আয়ন গঠিত হয়। আয়রন বাহক হিসাবে আয়রন (III) ব্রোমাইড ব্যবহার করে বেনজিন ব্রোমিনেশনের প্রক্রিয়াটি নিম্নরূপ উপস্থাপন করা যেতে পারে:

সালফোনেশন। ঘনীভূত সালফিউরিক অ্যাসিডের সাথে কয়েক ঘন্টার জন্য মিশ্রণটি রিফ্লাক্স করে বেনজিনকে সালফোনেটেড করা যেতে পারে (এতে একটি হাইড্রোজেন পরমাণুকে একটি সালফো গ্রুপ দিয়ে প্রতিস্থাপন করে)। পরিবর্তে, বেনজিনকে ফুমিং সালফিউরিক অ্যাসিডের সাথে মিশিয়ে আলতোভাবে গরম করা যেতে পারে। ফিউমিং সালফিউরিক অ্যাসিডে সালফার ট্রাইঅক্সাইড থাকে। এই প্রতিক্রিয়ার প্রক্রিয়াটি স্কিম দ্বারা প্রতিনিধিত্ব করা যেতে পারে

ফ্রিডেল-কারুশিল্পের প্রতিক্রিয়া। Friedel-Crafts বিক্রিয়াগুলিকে মূলত অ্যারোমেটিক যৌগ এবং অ্যালকাইল হ্যালাইডের মধ্যে ঘনীভবন বিক্রিয়া বলা হত একটি নির্জল অ্যালুমিনিয়াম ক্লোরাইড অনুঘটকের উপস্থিতিতে।
ঘনীভবন বিক্রিয়ায়, বিক্রিয়কগুলির দুটি অণু (বা একটি বিক্রিয়ক) একে অপরের সাথে মিলিত হয়, একটি নতুন যৌগের একটি অণু তৈরি করে, যখন জল বা হাইড্রোজেন ক্লোরাইডের মতো কিছু সরল যৌগের একটি অণু তাদের থেকে বিভক্ত হয় (নির্মূল করে) .
বর্তমানে, Friedel-Crafts বিক্রিয়া হল একটি সুগন্ধযুক্ত যৌগের যে কোনো ইলেক্ট্রোফিলিক প্রতিস্থাপন যেখানে একটি কার্বোকেশন বা ধনাত্মক চার্জযুক্ত কার্বন পরমাণু সহ একটি উচ্চ মেরুকৃত কমপ্লেক্স একটি ইলেক্ট্রোফিলের ভূমিকা পালন করে। ইলেক্ট্রোফিলিক এজেন্ট সাধারণত অ্যালকাইল হ্যালাইড বা কার্বক্সিলিক অ্যাসিডের ক্লোরাইড, যদিও এটিও হতে পারে, উদাহরণস্বরূপ, অ্যালকিন বা অ্যালকোহল। অ্যানহাইড্রাস অ্যালুমিনিয়াম ক্লোরাইড সাধারণত এই প্রতিক্রিয়াগুলির জন্য একটি অনুঘটক হিসাবে ব্যবহৃত হয়। ফ্রিডেল-ক্র্যাফ্টস প্রতিক্রিয়াগুলি সাধারণত দুটি প্রকারে বিভক্ত: অ্যালকিলেশন এবং অ্যাসিলেশন।
অ্যালকিলেশন। এই ধরনের ফ্রিডেল-ক্র্যাফ্ট বিক্রিয়ায়, বেনজিন বলয়ের এক বা একাধিক হাইড্রোজেন পরমাণু অ্যালকাইল গ্রুপ দ্বারা প্রতিস্থাপিত হয়। উদাহরণস্বরূপ, যখন অ্যানহাইড্রাস অ্যালুমিনিয়াম ক্লোরাইডের উপস্থিতিতে বেনজিন এবং ক্লোরোমিথেনের মিশ্রণকে সাবধানে গরম করা হয়, তখন মিথাইলবেনজিন তৈরি হয়। এই বিক্রিয়ায় ক্লোরোমিথেন একটি ইলেক্ট্রোফিলিক এজেন্টের ভূমিকা পালন করে। এটি অ্যালুমিনিয়াম ক্লোরাইড দ্বারা একইভাবে পোলারাইজ করা হয় যেমন হ্যালোজেন অণুর সাথে ঘটে:
বিবেচনাধীন প্রতিক্রিয়ার প্রক্রিয়াটি নিম্নরূপ উপস্থাপন করা যেতে পারে:

এটি লক্ষ করা উচিত যে বেনজিন এবং ক্লোরোমেথেনের মধ্যে এই ঘনীভবন বিক্রিয়ায়, একটি হাইড্রোজেন ক্লোরাইড অণু বিভক্ত হয়। আমরা আরও লক্ষ করি যে মুক্ত আয়ন আকারে ধাতব কার্বোকেশনের বাস্তব অস্তিত্ব সন্দেহজনক।
একটি অনুঘটকের উপস্থিতিতে ক্লোরোমেথেনের সাথে বেনজিনের অ্যালকিলেশন - অ্যানহাইড্রাস অ্যালুমিনিয়াম ক্লোরাইড মিথাইলবেনজিন গঠনের সাথে শেষ হয় না। এই প্রতিক্রিয়ায়, বেনজিন রিংয়ের আরও অ্যালকিলেশন ঘটে, যার ফলে 1,2-ডাইমিথাইলবেনজিন তৈরি হয়:

অ্যাসিলেশন। এই ধরণের ফ্রিডেল-ক্র্যাফ্টস বিক্রিয়ায়, বেনজিন রিং-এর হাইড্রোজেন পরমাণু একটি অ্যাসিল গ্রুপ দ্বারা প্রতিস্থাপিত হয়, যার ফলে একটি সুগন্ধযুক্ত কেটোন তৈরি হয়।
অ্যাসিল গ্রুপের সাধারণ সূত্র রয়েছে
একটি অ্যাসিল যৌগের পদ্ধতিগত নাম প্রত্যয় প্রতিস্থাপন করে এবং সংশ্লিষ্ট কার্বক্সিলিক অ্যাসিডের নামে শেষ -ova দিয়ে গঠিত হয়, যার মধ্যে প্রদত্ত অ্যাসিল যৌগটি একটি ডেরিভেটিভ, যার প্রত্যয় -(o)yl। উদাহরণ স্বরূপ

বেনজিনের অ্যাসিলেশন একটি অ্যালুমিনিয়াম ক্লোরাইড অনুঘটকের উপস্থিতিতে কার্বক্সিলিক অ্যাসিডের ক্লোরাইড বা অ্যানহাইড্রাইড ব্যবহার করে বাহিত হয়। উদাহরণ স্বরূপ

এই প্রতিক্রিয়াটি একটি ঘনীভবন যেখানে একটি হাইড্রোজেন ক্লোরাইড অণু নির্মূল হয়। আরও উল্লেখ্য যে "ফিনাইল" নামটি প্রায়শই যৌগগুলিতে বেনজিন রিং বোঝাতে ব্যবহৃত হয় যেখানে বেনজিন প্রধান গ্রুপ নয়:

সংযোজন প্রতিক্রিয়া। যদিও বেনজিন ইলেক্ট্রোফিলিক প্রতিস্থাপন প্রতিক্রিয়াগুলির সবচেয়ে বৈশিষ্ট্যযুক্ত, এটি কিছু সংযোজন বিক্রিয়াতেও প্রবেশ করে। আমরা ইতিমধ্যে তাদের একজনের সাথে দেখা করেছি। আমরা বেনজিনের হাইড্রোজেনেশন সম্পর্কে কথা বলছি (বিভাগ 5.3 দেখুন)। যখন বেনজিন এবং হাইড্রোজেনের মিশ্রণ 150-160 °C তাপমাত্রায় একটি সূক্ষ্ম স্থল নিকেল অনুঘটকের পৃষ্ঠের উপর দিয়ে যায়, তখন প্রতিক্রিয়াগুলির একটি সম্পূর্ণ ক্রম ঘটে, যা সাইক্লোহেক্সেন গঠনের সাথে শেষ হয়। এই প্রতিক্রিয়ার জন্য সামগ্রিক স্টোইচিওমেট্রিক সমীকরণটি নিম্নরূপ উপস্থাপন করা যেতে পারে:

অতিবেগুনী বিকিরণ বা সরাসরি সূর্যালোকের প্রভাবে বেনজিনও ক্লোরিনের সাথে বিক্রিয়া করে। এই প্রতিক্রিয়া একটি জটিল র্যাডিকাল প্রক্রিয়া দ্বারা বাহিত হয়। এর চূড়ান্ত পণ্য হল 1,2,3,4,5,6-হেক্সাক্লোরোসাইক্লোহেক্সেন:

অতিবেগুনী বিকিরণ বা সূর্যালোকের ক্রিয়ায় বেনজিন এবং ব্রোমিনের মধ্যে অনুরূপ প্রতিক্রিয়া ঘটে।
জারণ। বেনজিন এবং অন্যান্য সুগন্ধযুক্ত যৌগের বেনজিন রিং সাধারণত পটাসিয়াম পারম্যাঙ্গনেটের অ্যাসিডিক বা ক্ষারীয় দ্রবণের মতো শক্তিশালী অক্সিডাইজিং এজেন্ট দ্বারাও জারণ প্রতিরোধী। যাইহোক, বেনজিন এবং অন্যান্য সুগন্ধিগুলি বাতাসে বা অক্সিজেনে পুড়ে খুব ধোঁয়াটে শিখা তৈরি করে, যা উচ্চ আপেক্ষিক কার্বন সামগ্রী সহ হাইড্রোকার্বনের বৈশিষ্ট্য।
প্রতিক্রিয়াগুলির প্রথম গ্রুপটি প্রতিস্থাপন প্রতিক্রিয়া। আমরা বলেছিলাম যে অ্যারেনেসের আণবিক কাঠামোতে একাধিক বন্ধন থাকে না, তবে ছয়টি ইলেকট্রনের একটি সংযোজিত সিস্টেম থাকে, যা খুব স্থিতিশীল এবং বেনজিন রিংকে অতিরিক্ত শক্তি দেয়। অতএব, ইন রাসায়নিক বিক্রিয়ারহাইড্রোজেন পরমাণুর প্রতিস্থাপন প্রথমে ঘটে, বেনজিন রিং ধ্বংস নয়।
অ্যালকেন সম্পর্কে কথা বলার সময় আমরা ইতিমধ্যে প্রতিস্থাপন প্রতিক্রিয়ার সম্মুখীন হয়েছি, তবে তাদের জন্য এই প্রতিক্রিয়াগুলি একটি র্যাডিকাল প্রক্রিয়া অনুসারে এগিয়েছে এবং অ্যারেনের জন্য এটি বৈশিষ্ট্যযুক্ত। আয়নিক প্রক্রিয়াপ্রতিস্থাপন প্রতিক্রিয়া
প্রথমরাসায়নিক সম্পত্তি - হ্যালোজেনেশন। হ্যালোজেন পরমাণুর জন্য হাইড্রোজেন পরমাণুর প্রতিস্থাপন - ক্লোরিন বা ব্রোমিন।
প্রতিক্রিয়াটি উত্তপ্ত হলে এবং সর্বদা একটি অনুঘটকের অংশগ্রহণের সাথে এগিয়ে যায়। ক্লোরিন এর ক্ষেত্রে অ্যালুমিনিয়াম ক্লোরাইড বা আয়রন ক্লোরাইড তিন হতে পারে। অনুঘটক হ্যালোজেন অণুকে পোলারাইজ করে, ফলে হেটেরোলাইটিক বন্ড ভেঙে যায় এবং আয়ন পাওয়া যায়।
ধনাত্মক চার্জযুক্ত ক্লোরাইড আয়ন বেনজিনের সাথে বিক্রিয়া করে।
ব্রোমিনের সাথে বিক্রিয়া ঘটলে আয়রন ট্রাইব্রোমাইড বা অ্যালুমিনিয়াম ব্রোমাইড অনুঘটক হিসেবে কাজ করে।

এটি লক্ষ করা গুরুত্বপূর্ণ যে প্রতিক্রিয়াটি আণবিক ব্রোমিনের সাথে ঘটে এবং ব্রোমিন জলের সাথে নয়। বেনজিন ব্রোমিন জলের সাথে বিক্রিয়া করে না।
বেনজিন হোমোলগগুলির হ্যালোজেনেশনের নিজস্ব বৈশিষ্ট্য রয়েছে। টলিউইন অণুতে, মিথাইল গ্রুপটি রিংয়ে প্রতিস্থাপনের সুবিধা দেয়, প্রতিক্রিয়াশীলতা বৃদ্ধি পায় এবং প্রতিক্রিয়াটি মৃদু অবস্থায়, অর্থাৎ ইতিমধ্যে ঘরের তাপমাত্রায় এগিয়ে যায়।

এটি লক্ষ করা গুরুত্বপূর্ণ যে প্রতিস্থাপন সর্বদা অর্থো এবং প্যারা অবস্থানে ঘটে, তাই আইসোমারগুলির একটি মিশ্রণ পাওয়া যায়।
দ্বিতীয়সম্পত্তি - বেনজিনের নাইট্রেশন, বেনজিন রিংয়ে নাইট্রো গ্রুপের প্রবর্তন।

তিক্ত বাদামের গন্ধ সহ একটি ভারী হলুদ তরল তৈরি হয় - নাইট্রোবেনজিন, তাই প্রতিক্রিয়া বেনজিনের জন্য গুণগত হতে পারে। নাইট্রেশনের জন্য, ঘনীভূত নাইট্রিক এবং সালফিউরিক অ্যাসিডের একটি নাইট্রেটিং মিশ্রণ ব্যবহার করা হয়। প্রতিক্রিয়া গরম দ্বারা বাহিত হয়।
আমি আপনাকে মনে করিয়ে দিই যে কোনভালভ বিক্রিয়ায় অ্যালকেনগুলির নাইট্রেশনের জন্য, সালফিউরিক অ্যাসিড যোগ না করে পাতলা নাইট্রিক অ্যাসিড ব্যবহার করা হয়েছিল।
টলুইনের নাইট্রেশনে, সেইসাথে হ্যালোজেনেশনে, অর্থো- এবং প্যারা-আইসোমারের মিশ্রণ তৈরি হয়।

তৃতীয়সম্পত্তি - হ্যালোআলকেনসের সাথে বেনজিনের ক্ষারীয়করণ।

এই প্রতিক্রিয়া বেনজিন রিং মধ্যে একটি হাইড্রোকার্বন র্যাডিকেল প্রবর্তনের অনুমতি দেয় এবং বেনজিন হোমোলগ প্রাপ্ত করার জন্য একটি পদ্ধতি হিসাবে বিবেচনা করা যেতে পারে। অ্যালুমিনিয়াম ক্লোরাইড একটি অনুঘটক হিসাবে ব্যবহৃত হয়, যা হ্যালোঅ্যালকেন অণুর পচনকে আয়নে পরিণত করে। এটি গরম করারও প্রয়োজন।
চতুর্থসম্পত্তি - অ্যালকেনের সাথে বেনজিনের ক্ষারীয়করণ।

এইভাবে, উদাহরণস্বরূপ, কিউমিন বা ইথিলবেনজিন পাওয়া যেতে পারে। অনুঘটক হল অ্যালুমিনিয়াম ক্লোরাইড।
2. বেনজিনের সংযোজনের প্রতিক্রিয়া
প্রতিক্রিয়াগুলির দ্বিতীয় গ্রুপটি সংযোজন প্রতিক্রিয়া। আমরা বলেছিলাম যে এই প্রতিক্রিয়াগুলি বৈশিষ্ট্যযুক্ত নয়, তবে এগুলি পাই-ইলেক্ট্রন মেঘের ধ্বংস এবং ছয়টি সিগমা বন্ড গঠনের সাথে বরং কঠোর পরিস্থিতিতে সম্ভব।
পঞ্চমসাধারণ তালিকায় সম্পত্তি - হাইড্রোজেনেশন, হাইড্রোজেন সংযোজন।

তাপমাত্রা, চাপ, অনুঘটক নিকেল বা প্ল্যাটিনাম। টলুইন একইভাবে প্রতিক্রিয়া করতে সক্ষম।
ষষ্ঠসম্পত্তি - ক্লোরিনেশন। মনে রাখবেন যে আমরা কথা বলছিবিশেষত ক্লোরিনের সাথে মিথস্ক্রিয়া সম্পর্কে, যেহেতু ব্রোমিন এই প্রতিক্রিয়াতে প্রবেশ করে না।
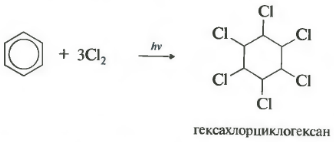
প্রতিক্রিয়া কঠিন অতিবেগুনী বিকিরণের অধীনে এগিয়ে যায়। হেক্সাক্লোরোসাইক্লোহেক্সেন, হেক্সাক্লোরেন এর অপর নাম, গঠিত হয়, একটি কঠিন।
এটা মনে রাখা গুরুত্বপূর্ণ যে বেনজিনের জন্য সম্ভব নাহাইড্রোজেন হ্যালাইডের সংযোজন প্রতিক্রিয়া (হাইড্রোহ্যালোজেনেশন) এবং জলের সংযোজন (হাইড্রেশন)।
3. বেনজিন হোমোলগগুলির পার্শ্ব শৃঙ্খলে প্রতিস্থাপন
প্রতিক্রিয়াগুলির তৃতীয় গ্রুপটি শুধুমাত্র বেনজিন হোমোলগগুলিকে উদ্বেগ করে - এটি সাইড চেইনের একটি প্রতিস্থাপন।
সপ্তমসাধারণ তালিকার একটি বৈশিষ্ট্য হল সাইড চেইনের আলফা কার্বন পরমাণুতে হ্যালোজেনেশন।

উত্তপ্ত বা বিকিরণিত হলে এবং সর্বদা শুধুমাত্র আলফা কার্বনে প্রতিক্রিয়া ঘটে। হ্যালোজেনেশন চলতে থাকলে, দ্বিতীয় হ্যালোজেন পরমাণু আলফা অবস্থানে ফিরে আসবে।
4. বেনজিন হোমোলগগুলির জারণ
বিক্রিয়ার চতুর্থ গ্রুপ হল জারণ।
বেনজিন রিং খুব শক্তিশালী, তাই বেনজিন অক্সিডাইজ করে নাপটাসিয়াম পারম্যাঙ্গনেট - এর দ্রবণকে বিবর্ণ করে না। এই মনে রাখা খুব গুরুত্বপূর্ণ.
অন্যদিকে, বেনজিন হোমোলগগুলি উত্তপ্ত হলে পটাসিয়াম পারম্যাঙ্গানেটের একটি অম্লীয় দ্রবণ দিয়ে জারিত হয়। এবং এটি অষ্টম রাসায়নিক সম্পত্তি।

এটা benzoic অ্যাসিড সক্রিয় আউট. দ্রবণের বিবর্ণতা পরিলক্ষিত হয়। এই ক্ষেত্রে, বিকল্পের কার্বন চেইন যত দীর্ঘই হোক না কেন, এটি সর্বদা প্রথম কার্বন পরমাণুর পরে ভেঙে যায় এবং আলফা পরমাণুটি বেনজোয়িক অ্যাসিড গঠনের সাথে কার্বক্সিল গ্রুপে জারিত হয়। বাকি অণু সংশ্লিষ্ট অ্যাসিডে জারিত হয় বা, যদি এটি শুধুমাত্র একটি কার্বন পরমাণু হয়, তাহলে কার্বন ডাই অক্সাইডে।
যদি বেনজিন হোমোলগের সুগন্ধি রিংটিতে একাধিক হাইড্রোকার্বন বিকল্প থাকে তবে একই নিয়ম অনুসারে জারণ ঘটে - আলফা অবস্থানে থাকা কার্বনটি অক্সিডাইজ হয়।

এই উদাহরণে, একটি dibasic সুগন্ধি অ্যাসিড প্রাপ্ত হয়, যা phthalic অ্যাসিড বলা হয়।
একটি বিশেষ উপায়ে, আমি সালফিউরিক অ্যাসিডের উপস্থিতিতে বায়ুমণ্ডলীয় অক্সিজেনের সাথে কিউমেন, আইসোপ্রোপাইলবেনজিনের অক্সিডেশন নোট করি।

এটি ফেনল উৎপাদনের জন্য তথাকথিত কিউমিন পদ্ধতি। একটি নিয়ম হিসাবে, একজনকে ফেনল উত্পাদন সম্পর্কিত বিষয়ে এই প্রতিক্রিয়াটির সাথে মোকাবিলা করতে হবে। এটি শিল্প উপায়।
নবমসম্পত্তি - দহন, সম্পূর্ণ জারণঅক্সিজেন. বেনজিন এবং এর হোমোলগগুলি কার্বন ডাই অক্সাইড এবং জলে পুড়ে যায়।
আসুন সাধারণ আকারে বেনজিনের দহনের সমীকরণটি লিখি।
ভর সংরক্ষণের আইন অনুসারে, ডানদিকে যত পরমাণু রয়েছে বাম দিকে ততগুলি পরমাণু থাকা উচিত। কারণ, সর্বোপরি, রাসায়নিক বিক্রিয়ায়, পরমাণুগুলি কোথাও যায় না, তবে তাদের মধ্যে বন্ধনের ক্রমটি কেবল পরিবর্তিত হয়। সুতরাং একটি অ্যারিন অণুতে যতগুলি কার্বন পরমাণু রয়েছে ততগুলি কার্বন ডাই অক্সাইড অণু থাকবে, যেহেতু অণুটিতে একটি কার্বন পরমাণু রয়েছে। সেটি হল n CO 2 অণু। হাইড্রোজেন পরমাণুর মতো অর্ধেক জলের অণু থাকবে, অর্থাৎ (2n-6)/2, যার মানে n-3।
বাম এবং ডানদিকে একই সংখ্যক অক্সিজেন পরমাণু রয়েছে। ডানদিকে, কার্বন ডাই অক্সাইড থেকে 2n আছে, কারণ প্রতিটি অণুতে দুটি অক্সিজেন পরমাণু রয়েছে, প্লাস পানি থেকে n-3, মোট 3n-3 এর জন্য। বাম দিকে, একই সংখ্যক অক্সিজেন পরমাণু রয়েছে - 3n-3, যার অর্থ অর্ধেক অণু রয়েছে, কারণ অণুটিতে দুটি পরমাণু রয়েছে। অর্থাৎ (3n-3)/2 অক্সিজেন অণু।
এইভাবে, আমরা একটি সাধারণ আকারে বেনজিন হোমোলগগুলির দহনের জন্য সমীকরণটি সংকলন করেছি।
সংজ্ঞা
বেনজিন- এটি একটি চরিত্রগত গন্ধ সহ একটি বর্ণহীন তরল; স্ফুটনাঙ্ক 80.1 o C, গলনাঙ্ক 5.5 o C। জলে অদ্রবণীয়, বিষাক্ত।
বেনজিনের সুগন্ধযুক্ত বৈশিষ্ট্য, এর গঠন বৈশিষ্ট্য দ্বারা নির্ধারিত, বেনজিনের রিং এর আপেক্ষিক স্থায়িত্বে প্রকাশ করা হয়, গঠনে বেনজিনের অসম্পৃক্ততা থাকা সত্ত্বেও। এইভাবে, ইথিলিন ডাবল বন্ড সহ অসম্পৃক্ত যৌগগুলির বিপরীতে, বেনজিন অক্সিডাইজিং এজেন্টদের প্রতিরোধী।
ভাত। 1. কেকুল অনুসারে বেনজিন অণুর গঠন।
বেনজিন পাচ্ছেন
বেনজিন পাওয়ার প্রধান উপায়গুলির মধ্যে রয়েছে:
- হেক্সেন এর ডিহাইড্রোসাইক্লাইজেশন (অনুঘটক - Pt, Cr 3 O 2)
CH 3 -(CH 2) 4 -CH 3 → C 6 H 6 + 4H 2 (t o C, p, kat \u003d Cr 2 O 3);
- সাইক্লোহেক্সেন এর ডিহাইড্রোজেনেশন
C 6 H 12 → C 6 H 6 + 3H 2 (t o C, kat = Pt, Ni);
- অ্যাসিটিলিনের ট্রিমারাইজেশন (600 o C-তে উত্তপ্ত হলে প্রতিক্রিয়াটি এগিয়ে যায়, অনুঘটকটি সক্রিয় কার্বন হয়)
3HC≡CH → C 6 H 6 (t = 600 o C, kat = C সক্রিয়)।
বেনজিনের রাসায়নিক বৈশিষ্ট্য
বেনজিন ইলেক্ট্রোফিলিক প্রক্রিয়া অনুসারে প্রতিস্থাপন প্রতিক্রিয়া দ্বারা চিহ্নিত করা হয়:
হ্যালোজেনেশন (বেঞ্জিন অনুঘটকের উপস্থিতিতে ক্লোরিন এবং ব্রোমিনের সাথে যোগাযোগ করে - অ্যানহাইড্রাস AlCl 3 , FeCl 3 , AlBr 3)
C 6 H 6 + Cl 2 \u003d C 6 H 5 -Cl + HCl;
- নাইট্রেশন (বেনজিন সহজেই নাইট্রেটিং মিশ্রণের সাথে বিক্রিয়া করে - ঘনীভূত নাইট্রিক এবং সালফিউরিক অ্যাসিডের মিশ্রণ)

- অ্যালকিনসের সাথে অ্যালকিলেশন
C 6 H 6 + CH 2 \u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2
বেনজিনের অতিরিক্ত প্রতিক্রিয়া সুগন্ধি সিস্টেমের ধ্বংসের দিকে নিয়ে যায় এবং শুধুমাত্র কঠোর পরিস্থিতিতে এগিয়ে যায়:
- হাইড্রোজেনেশন (প্রতিক্রিয়া পণ্য - সাইক্লোহেক্সেন)
C 6 H 6 + 3H 2 → C 6 H 12 (t o C, kat = Pt);
- ক্লোরিন সংযোজন (একটি কঠিন পণ্য গঠনের সাথে ইউভি বিকিরণের ক্রিয়ায় ঘটে - হেক্সাক্লোরোসাইক্লোহেক্সেন (হেক্সাক্লোরান) - C 6 H 6 Cl 6)
C 6 H 6 + 6Cl 2 → C 6 H 6 Cl 6।
বেনজিনের প্রয়োগ
বেনজিন ব্যাপকভাবে শিল্প জৈব রসায়নে ব্যবহৃত হয়। বেনজিনের রিং আছে এমন প্রায় সব যৌগই বেনজিন থেকে পাওয়া যায়, উদাহরণস্বরূপ, স্টায়ারিন, ফেনল, অ্যানিলিন, হ্যালোজেন-প্রতিস্থাপিত অ্যারেনস। বেনজিন রঞ্জক, সার্ফ্যাক্ট্যান্ট এবং ফার্মাসিউটিক্যালস সংশ্লেষণের জন্য ব্যবহৃত হয়।
সমস্যা সমাধানের উদাহরণ
উদাহরণ 1
| ব্যায়াম | পদার্থের বাষ্পের ঘনত্ব 3.482 g/l। এর পাইরোলাইসিস থেকে 6 গ্রাম কাঁচ এবং 5.6 লিটার হাইড্রোজেন পাওয়া যায়। এই পদার্থের সূত্র নির্ধারণ করুন। |
| সিদ্ধান্ত | কালি হল কার্বন। আসুন সমস্যার অবস্থার উপর ভিত্তি করে কাঁচের পদার্থের পরিমাণ খুঁজে বের করি (কার্বনের মোলার ভর হল 12 গ্রাম/মোল): n(C) = m(C) / M(C); n(C) \u003d 6 / 12 \u003d 0.5 mol। হাইড্রোজেন পদার্থের পরিমাণ গণনা করুন: n(H 2) \u003d V (H 2) / V m; n (H 2) \u003d 5.6 / 22.4 \u003d 0.25 mol। সুতরাং, একটি হাইড্রোজেন পরমাণুর পদার্থের পরিমাণ সমান হবে: n(H) = 2 × 0.25 = 0.5 mol। আসুন হাইড্রোকার্বন অণুতে কার্বন পরমাণুর সংখ্যাকে "x" হিসাবে এবং হাইড্রোজেন পরমাণুর সংখ্যাটিকে "y" হিসাবে চিহ্নিত করি, তারপর অণুতে এই পরমাণুর অনুপাত: x: y \u003d 0.5: 0.5 \u003d 1: 1। তারপর সহজতম হাইড্রোকার্বন সূত্রটি CH রচনা দ্বারা প্রকাশ করা হবে। CH রচনার একটি অণুর আণবিক ওজন হল: M(CH) = 13 g/mol আসুন সমস্যার অবস্থার উপর ভিত্তি করে হাইড্রোকার্বনের আণবিক ওজন খুঁজে বের করি: M (C x H y) = ρ × V m ; M (C x H y) \u003d 3.482 × 22.4 \u003d 78 g/mol। আসুন হাইড্রোকার্বনের আসল সূত্রটি সংজ্ঞায়িত করি: k \u003d M (C x H y) / M (CH) \u003d 78/13 \u003d 6, অতএব, সহগ "x" এবং "y" কে অবশ্যই 6 দ্বারা গুণ করতে হবে এবং তারপর হাইড্রোকার্বন সূত্রটি C 6 H 6 রূপ নেবে। এটা বেনজিন। |
| উত্তর | কাঙ্ক্ষিত হাইড্রোকার্বনের গঠন C 6 H 6 আছে। এটা বেনজিন। |
উদাহরণ 2
| ব্যায়াম | 400 মিলি বেনজিন (ঘনত্ব 0.8 গ্রাম/মিলি) তৈরি করতে প্রয়োজনীয় অ্যাসিটিলিনের পরিমাণ গণনা করুন। |
| সিদ্ধান্ত | আমরা অ্যাসিটিলিন থেকে বেনজিন উৎপাদনের জন্য প্রতিক্রিয়া সমীকরণ লিখি:
শেয়ার করুন
|




